Каждый из живых организмов на Земле носит в клетках наследственный материал своих предков. Эти данные называются геномами, и они нужны непосредственно для создания и поддержания деятельности организма. Генная инженерия работает над изменениями в наследственной информации. Рассказываем, что происходит с редактированием геномов прямо сейчас.
Читайте «Хайтек» в
Применение генной инженерии в научных исследованиях
Для изучения функции того или иного гена может быть применён нокаут гена. Так называется техника удаления одного или большего количества генов, что позволяет исследовать последствия подобной мутации.
Для нокаута синтезируют такой же ген или его фрагмент, измененный так, чтобы продукт гена потерял свою функцию. Основные методы реализации: цинковый палец, морфолино и TALEN.
Для получения нокаутных мышей полученную генно-инженерную конструкцию вводят в эмбриональные стволовые клетки, где конструкция подвергается соматической рекомбинации и замещает нормальный ген, а измененные клетки имплантируют в бластоцисту суррогатной матери. У плодовой мушки дрозофилы мутации инициируют в большой популяции, в которой затем ищут потомство с нужной мутацией. Сходным способом получают нокаут у растений и микроорганизмов.
Введение в генную инженерию (видео 1) | Генная инженерия |Молекулярная генетика
Логичным дополнением нокаута является искусственная экспрессия, то есть добавление в организм гена, которого у него ранее не было. Этот способ генной инженерии также можно использовать для исследования функции генов. В сущности процесс введения дополнительных генов таков же, как и при нокауте, но существующие гены не замещаются и не повреждаются.
Используется, когда задачей является изучение локализации продукта гена. Одним из способов мечения является замещение нормального гена на слитый с репортерным элементом, например, с геном зеленого флуоресцентного белка GFP. Этот белок, флуоресцирующий в голубом свете, используется для визуализации продукта генной модификации.
Хотя такая техника удобна и полезна, её побочными следствиями может быть частичная или полная потеря функции исследуемого белка. Более изощрённым, хотя и не столь удобным методом является добавление к изучаемому белку не столь больших олигопептидов, которые могут быть обнаружены с помощью специфических антител.
В таких экспериментах задачей является изучение условий экспрессии гена. Особенности экспрессии зависят прежде всего от небольшого участка ДНК, расположенного перед кодирующей областью, который называется промотор и служит для связывания факторов транскрипции.
Этот участок вводят в организм, поставив после него вместо собственного гена репортерный, например, GFP или фермента, катализирующего легко обнаруживаемую реакцию. Кроме того, что функционирование промотора в тех или иных тканях в тот или иной момент становится хорошо заметным, такие эксперименты позволяют исследовать структуру промотора, убирая или добавляя к нему фрагменты ДНК, а также искусственно усиливать его функции.
Зачем нужна генная инженерия человека
В применении к человеку генная инженерия могла бы применяться для лечения наследственных болезней. Однако, технически, есть существенная разница между лечением самого пациента и изменением генома его потомков.
#1. Основные этапы работы генетического алгоритма | Генетические алгоритмы на Python
Задача изменения генома взрослого человека несколько сложнее, чем выведение новых генноинженерных пород животных, поскольку в данном случае требуется изменить геном многочисленных клеток уже сформировавшегося организма, а не одной лишь яйцеклетки-зародыша. Для этого предлагается использовать вирусные частицы в качестве вектора.
Вирусные частицы способны проникать в значительный процент клеток взрослого человека, встраивая в них свою наследственную информацию; возможно контролируемое размножение вирусных частиц в организме. При этом для уменьшения побочных эффектов учёные стараются избегать внедрения генноинженерных ДНК в клетки половых органов, тем самым избегая воздействия на будущих потомков пациента.
Также стоит отметить значительную критику этой технологии в СМИ: разработка генноинженерных вирусов воспринимается многими как угроза для всего человечества.
С помощью генотерапии в будущем возможно изменение генома человека. В настоящее время эффективные методы изменения генома человека находятся на стадии разработки и испытаний на приматах.
Долгое время генетическая инженерия обезьян сталкивалась с серьёзными трудностями, однако в 2009 году эксперименты увенчались успехом: в журнале Nature появилась публикация об успешном применении генноинженерных вирусных векторов для излечения взрослого самца обезьяны от дальтонизма. В этом же году дал потомство первый генетически модифицированный примат (выращенный из модифицированной яйцеклетки) — обыкновенная игрунка (Callithrix jacchus).
Хотя и в небольшом масштабе, генная инженерия уже используется для того, чтобы дать шанс забеременеть женщинам с некоторыми разновидностями бесплодия. Для этого используют яйцеклетки здоровой женщины. Ребёнок в результате наследует генотип от одного отца и двух матерей.
Однако возможность внесения более значительных изменений в геном человека сталкивается с рядом серьёзных этических проблем. В 2016 в США группа учёных получила одобрение на клинические испытания метода лечения рака с помощью собственных иммунных клеток пациента, подвергаемых генной модификации с применением технологии CRISPR/Cas9.
В конце 2018 года в Китае родились двое детей, геном которых был искусственно изменён (выключен ген CCR5) на стадии эмбриона методом CRISPR/Cas9, в рамках исследований, проводимых с 2016 года по борьбе с ВИЧ. Один из родителей (отец) был ВИЧ-инфицированным, а дети, по заявлению, родились здоровыми.
Поскольку эксперимент был несанкционированным (до этого все подобные эксперименты на человеческом эмбрионе разрешались только на ранних стадиях развития с последующим уничтожением экспериментального материала, то есть без имплантации эмбриона в матку и рождением детей), ответственный за него учёный не предоставил доказательств своим заявлениям, которые были сделаны на международной конференции по редактированию генома.
В конце января 2019 года властями Китая были официально подтверждены факты проведения данного эксперимента. Тем временем учёному было запрещено заниматься научной деятельностью и он был арестован.
Как редактируют человеческий геном?
«Цинковые пальцы» встречаются и в составе человеческих белков. Благодаря этому методу можно сконструировать цепь ZFN так, что она будет узнавать определённый участок ДНК. Это дает возможность точечного воздействия на заданные участки в составе сложных геномов.
Домены «цинковые пальцы» встречаются в составе человеческих факторов транскрипции – белков, регулирующих процесс синтеза РНК с матрицей ДНК. При создании искусственных нуклеаз можно сконструировать цепочку из «цинковых пальцев» так, что она будет узнавать определенный участок ДНК.
Если такая цепочка будет достаточно длинной, она может распознавать относительно протяженные последовательности ДНК, состоящие из ряда тринуклеотидных фрагментов. Это означает реальную возможность точечного воздействия на заданные участки в составе больших сложных геномов.
Однако у метода «цинковых пальцев» обнаружились и серьезные недостатки: во-первых, это не вполне строгое распознавание тринуклеотидных повторов, что приводит к заметному числу расщеплений ДНК в «нецелевых» участках.
Во-вторых, метод оказался весьма трудозатратным и дорогостоящим, поскольку для каждой последовательности ДНК необходимо создать свою оптимизированную белковую структуру zinc-finger нуклеазы. Поэтому система «цинковые пальцы» широкого распространения не получила.
В 2011 году журнал Nature Methods назвал систему TALEN (Transcription Activator-like Effector Nucleases) «методом года» благодаря широкому спектру возможных применений в разных областях фундаментальной и прикладной науки.
TALEN — один из способов направленного внесения разрыва в ДНК с последующим его «залечиванием» — для выключения генов у мышей. Сразу после них эту технологию применили для внесения в мышиный геном мутации, приводящей к развитию одного из наследственных синдромов. Авторам метода моделирования генетически обусловленных болезней удалось не только «испортить» мышиный геном, но и исправить его обратно.
Метод обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.
В основе этой системы — особые участки бактериальной ДНК — CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats, или короткие палиндромные кластерные повторы). Разделяют эти повторы спейсеры — короткие фрагменты чужеродной ДНК. Последние встраиваются в геном после того, как ДНК рекомбинирует с её геномом.
Примеры редактирования человека
- Редактирование генома прямо в теле
Заболевание 44-летнего жителя Аризоны Брайана Мадо проявилось еще в раннем детстве. Оно неизлечимо и наследуют его в основном мужчины. Мукополисахаридоз II типа — это метаболическое расстройство: у людей с ним есть мутация в гене, ответственном за производство фермента, который участвует в расщеплении сложных углеводов. В итоге они накапливаются в клетках и вызывают многочисленные патологии органов.
Мужчина решил принять участие в клиническом испытании нового метода — генной терапии. Это лишь первая фаза исследования, а всего до регистрации терапии (то есть до разрешения применять этот метод для всех больных с синдромом Хантера) их должно быть три.
Метод, который использовали в случае Брайана Мадо, позволяет редактировать геном прямо в теле человека — и при этом достаточно точно попадать в конкретный участок ДНК. Редактирование происходит с помощью так называемых «цинковых пальцев».
Китайский исследователь Хэ Цзянькуй отредактировал геномы человеческих эмбрионов перед процедурой искусственного оплодотворения, в результате чего на свет появились двое детей с измененной ДНК.
С помощью системы CRISPR/Cas9 исследователь отредактировал геномы эмбрионов семи пар во время репродуктивного лечения. В результате одной из беременностей от здоровой матери и ВИЧ-инфицированного отца родились две девочки-двойняшки с измененной ДНК. Хэ Цзянькуй пояснил, что удалил у детей ген CCR5, благодаря чему они получили пожизненный иммунитет к ВИЧ.
- Возвращение зрения с помощью генной терапии
Для восстановления зрения можно использовать оптогенетические технологии, с помощью которых работой нейронов можно управлять с помощью светочувствительных белков бактерий и вспышек лазера.
Руководствуясь этой идеей, биологи создали вирус, который может проникать в ганглионарные нейроны. Эти нервные клетки отвечают за передачу сигналов из сетчатки в мозг человека. Попавший в ганглионарный нейрос вирус заставляет его производить подобные сигнальные молекулы. Однако эта процедура не возвращает зрение сама по себе, так как белки бактерий реагируют на свет не так, как палочки и колбочки сетчатки.
Чтобы решить эту проблему, профессор Базельского университета Ботонд Роска и профессор Питтсбургского университета Хосе Сахель создали специальные очки, которые преобразуют поступающие в них изображение в понятный мозгу формат и стимулируют ганглионарные клетки вспышками лазера. В результате пациент может видеть силуэты крупных предметов и объектов и совершать другие сложные действия
Читать далее:
Источник: hightech.fm
6.2.1. Генетическое программирование
Методы генетического программирования были разработаны в начале 1990-х гг. Дж. Козой [27 — 29]. Генетическое программирование — это способ создания компьютерных программ для задач с неизвестным алгоритмом решения. Объектом эволюции является программа, а популяция содержит множество различных программ.
Совершенствование объекта осуществляется на основе отбора в соответствии с определенной функцией ценности (fitness function). Программы строятся из блоков, которые представляют собой примитивные функции и терминалы. В качестве примитивных функций обычно рассматриваются арифметические и логические операции, математические функции и функции специального вида, характерные для класса решаемых задач. Множество терминалов содержит разнообразные данные, не создаваемые программой. Цель состоит в построении наилучшей программы в пространстве программ, которые могут быть составлены из заданных функций и терминалов с учетом определенных правил синтаксиса.
Технология генетического программирования включает cле-дующие этапы.
Этап 1. Формирование множества терминалов, множества примитивных функций, синтаксических правил и критериев оценки создаваемых программ.
Этап 2. На основе закона случайности создается начальная популяция компьютерных программ, ориентированных на решение поставленной задачи.
Этап 3. Каждая программа выполняется, а результаты ее работы оцениваются с помощью fitness function (целевой функции).
Этап 4. Формируется новая популяция программ, в которую сгенерированные программы могут попасть с вероятностью, пропорциональной значению целевой функции.
Этап 5. Реализуются генетические операторы репродукции, скрещивания и мутации. В результате репродукции осуществляется копирование уже созданных программ с хорошими значениями целевой функции. Оператор скрещивания создает новые программы путем комбинирования фрагментов существующих программ. Мутация заключается в замене некоторого фрагмента программы случайно порожденным символьным выражением.
Этап 6. Производится тестирование программ-членов новой популяции и принимается решение о продолжении процесса эволюции. Продолжать генерацию новых популяций имеет смысл тогда, когда максимальные и средние значения целевой функции улучшаются.
Рассмотрим пример [27] модификации программы на языке LISP, где в качестве терминалов используются переменные логического типа а для их обработки применяются логические операции
а для их обработки применяются логические операции Пусть на некотором шаге имеется следующее множество допустимых выражений:
Пусть на некотором шаге имеется следующее множество допустимых выражений:

Эти выражения можно представить в виде деревьев (рис. 6.9). В процессе эволюции на уровне поддеревьев осуществляется рекомбинация и получаются потомки (рис. 6.10). Первый из этих

потомков представляет собой реализацию операции исключающего ИЛИ:

Результатом применения оператора мутации является замена части дерева другим выражением, сгенерированным случайным образом. Точка мутации также выбирается случайно.
Идеи генетического программирования положены в основу программ, которые называются симуляторами «искусственной жизни». В работе Дж. Козы [27] приводится следующий пример подобной программы. На тороидальной сетке размером 32×32, в 89 ячейках помещается «пища».
Существуют некие препятствия, мешающие «насекомым» добраться до «пищи». «Насекомые» попадают на сетку из одной точки, и каждое движется согласно командам своей программы. В начальной популяции эти программы формируются случайным образом из операторов, которые проверяют наличие препятствий и предписывают движение прямо, влево или вправо. Задается время жизни популяции (400 ша-
Рис. 6.9. Представление символьных выражений языка LISP в виде деревьев

Рис. 6.10. Потомки от скрещивания родителей на уровне поддеревьев
гов). Цена каждой программы определяется числом шагов, которые необходимо совершить, чтобы обойти все ячейки с «пищей». Каждая следующая популяция формируется из предыдущей с помощью генетических операторов репродукции, скрещивания и мутации с учетом ценности программ предыдущей популяции. Решение для популяции из 4000 «насекомых» было найдено за 20 итераций.
Последователи Дж. Козы исследовали в своих работах возможность использования ГП для синтеза сложных автоматов, а также для структурной идентификации динамических систем [19].
В примере построения экономической балансовой модели [13] поставлена цель уточнения эконометрического уравнения обмена, связывающего уровень цен, валовой национальный продукт (ВНП), запас денег и скорость оборота денег в экономике.
В качестве терминалов здесь используются следующие переменные: ВНП82 — уровень ВНП за 1982 г.; GD — дефлятор ВНП (выходная переменная модели), нормализованный к единице для 1982 г.; FM- ежемесячная величина запаса денег. Приведенные переменные являются функциями времени. Их значения определяются на основе статистических данных в виде временных рядов. Кроме того, используется множество обобщенных констант действительного типа R.
Для обработки переменных предусмотрены следующие операции: сложение (+); вычитание (-); умножение (*); защищенное деление (%), результатом которого является единица при попытке разделить на 0; защищенное логарифмирование (RLOG), дающее 1 при нулевом значении аргумента; вычисление экспоненты (ЕХР).
Грубая оценка пригодности сгенерированных уравнений вычисляется как сумма квадратов отклонений расчетных значений от фактических в заданных экспериментальных точках:

Значение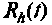 масштабируется в целях получения нормированной оценки пригодности
масштабируется в целях получения нормированной оценки пригодности которая изменяется
которая изменяется

на интервале [0, 1] и позволяет перейти к задаче максимизации. На основевычисляется относительная нормированная

оценка пригодности которая имеет более

высокие значения для лучших членов популяции и обладает свойствомдопускающим вероятностную интерпре-
Критерием окончания процесса эволюции является достижение заданного числа генераций (50) или достижение наилучшего значения целевой функции. Численность популяции была принята равной 500. В процессе генерации новых поколений скрещивание проводилось на 9Q% численности популяции, т.е. из каждого поколения выбиралось 225 пар родителей с вероятностью, равной относительной оценке их пригодности. Кроме того, для каждой новой популяции осуществлялась репродукция 10% лучших представителей поколения.
Генерируемые модели (программы) удобно представить в виде древовидных структур (рис. 6.11).

Рис. 6.11. Древовидное представление компьютерных моделей, отобранных для скрещивания: а — родитель 1; б — родитель 2

Представленные на рис. 6.11 модели соответствуют выражениямОперацияскрещивания начинается со случайного и независимого выбора точки кроссинговера в каждой из двух моделей-родителей. Отсеченные фрагменты программ-родителей, обозначенные пунктиром, меняются местами, и в результате образуются две модели-потомка (рис. 6.12). Потомкам соответствуют уравнения


Рис. 6.12. Модели-потомки, полученные в результате скрещивания
Оператор мутации в данном примере выполнялся путем замены функций в узлах деревьев либо путем случайного изменения значений констант.
Используя статистические данные за 30 лет (заметим, что в примере исследовалась экономика США в период с 1959 по 1988 г.), генетический алгоритм за 50 последовательных генераций выдал наилучшее решение которое хорошо согласуется с известным эконометрическим уравнением обмена
которое хорошо согласуется с известным эконометрическим уравнением обмена гдеР — уровень цен; М — запасы денежной массы; V— скорость обращения денег в экономике; Q — валовой национальный продукт.
гдеР — уровень цен; М — запасы денежной массы; V— скорость обращения денег в экономике; Q — валовой национальный продукт.
Источник: studfile.net
Молекулярные основы генетической инженерии
Генетическая инженерия представляет собой конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК), или, иначе, — создание искусственных генетических программ (академик А.А Баев). По Э.С. Пирузян, генетическая инженерия — это система экспериментальных приемов, позволяющих конструировать

Рис. 4.1. Двойная спираль ДНК
лабораторным путем (в пробирке) искусственные генетические структуры в виде так называемых рекомбинантных, или гибридных, молекул ДНК. Следовательно, основным объектом генетической инженерии является молекула ДНК, в которой закодирована вся информация о строении и функционировании любой живой клетки.
ДНК — это полимерная двухцепочечная молекула, построенная по принципу комплементарности (рис. 4.1). Комплемен- тарность обеспечивает, во-первых, стабильность молекулы, во-вторых, — точное воспроизведение при построении дочерних цепочек. Мономером ДНК служат четыре типа нуклеотидов, каждый из которых состоит из сахара — дезоксирибозы, фосфатной группы и азотистого основания.
Нуклеотиды различают по азотистым основаниям, которые подразделяют на две группы: пуриновые (аденин и гуанин) и пиримидиновые (цитозин и тимин); в молекулах другой нуклеиновой кислоты — РНК — вместо тимина встречается урацил (рис. 4.2). Между пуриновыми и пиримидиновыми основаниями возникают комплементарные взаимодействия (А — Т и Г — Ц), которые удерживают цепочки, состоящие из дезоксирибозы и фосфатной группы, относительно друг друга.
Размер молекулы ДНК измеряется числом пар комплементарных нуклеотидов — от нескольких тысяч пар нуклеотидов (т. п. н.) до миллионов пар нуклеотидов (м. п. н.). У человека длина ДНК, составляющей первую хромосому, составляет 263 м. п. н.
Молекулы ДНК представляют собой генетическую информацию, важной единицей которой являются гены — элементарные носители, кодирующие информацию о синтезе одного определенного продукта. Поэтому каждый ген характеризуется строго определенной последовательностью нуклеотидов. Большая часть генов содержит информацию о строении белков, а некоторые кодируют только определенные молекулы РНК (например, рибосомальную РНК).

Рис. 4.2. Пуриновые (а) и пиримидиновые (б) азотистые основания (по В.П. Комову и В.Н. Шведовой, 2004)
Как уже отмечалось, в основе генетической инженерии лежит целенаправленное конструирование искусственных генетических систем вне организма и их введение в живой организм с целью создания нового организма (или модификации существующего). Это предполагает, что часть генов можно с помощью специальных ферментов вырезать из молекулы ДНК одного организма (донорная ДНК) и перенести в другой, реципиентный, организм. Такой перенос генов называется трансгенозом, а организмы, в ДНК которых включены чужеродные гены, носят название трансгенных.
Используемые для переноса генетические конструкции носят название рекомбинантных ДНК. В их состав входят фрагмент донорной ДНК (клонируемая ДНК) и векторная ДНК (вектор, который отвечает за перенесение и встраивание — интеграцию — клонируемой ДНК). Молекулы рекомбинантной ДНК создают для клонирования необходимых участков ДНК, картирования ДНК, создания трансгенных организмов, массового получения продуктов, закодированных данным участком ДНК. Рекомбинантные ДНК становятся составной частью генетического аппарата реципиент- ного организма и обеспечивают ему новые уникальные генетические, биохимические, а затем и физиологические свойства.
Технология получения рекомбинантных ДНК включает следующие методические подходы:
- 1. Специфическое расщепление ДНК эндонуклеазами рестрикции, ускоряющее выделение и манипуляции с отдельными генами.
- 2. Быстрое секвенирование всех нуклеотидов в определенном фрагменте ДНК, что позволяет определить границы гена и кодируемую им аминокислотную последовательность.
- 3. Конструирование рекомбинантной ДНК.
- 4. Гибридизация нуклеиновых кислот, позволяющая выявлять с большой точностью и чувствительностью специфические последовательности РНК или ДНК, основанные на их способности связывать комплементарные последовательности нуклеиновых кислот.
- 5. Клонирование ДНК путем введения ее фрагмента в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий, или амплификация in vitro; создание геномных библиотек.
- 6. Введение рекомбинантной ДНК в клетки или организмы.
Остановимся на этих технологиях более подробно.
Большинство ферментов выделяют из клеток бактерий и используют для «разрезания» или «сшивания» ДНК как прокариотических, так и эукариотических клеток.
Применяемые при конструировании рекомбинантных ДНК ферменты можно подразделить на несколько групп:
- — ферменты, с помощью которых выделяют фрагменты ДНК (рестриктазы);
- — ферменты, синтезирующие ДНК на матрице ДНК (ДНК-полимеразы) или РНК (обратные транскриптазы, ревертазы );
- — ферменты, соединяющие фрагменты ДНК (лигазы);
- — ферменты, изменяющие строение концов фрагментов ДНК.
Рестриктазы (эндонуклеазы рестрикции) — ферменты, с помощью которых выделяют фрагменты ДНК. Эти высокоспецифичные ферменты узнают и расщепляют определенные последовательности азотистых оснований в молекуле ДНК (сайты рестрикции). В генетической инженерии рестриктазы предназначены для вырезания необходимых участков из молекул донорной ДНК.
Рестриктазы выделяют из бактерий, но они также выявлены у дрожжей и одноклеточных водорослей. Номенклатура рестриктаз была предложена в 1973 г. С. Смитом и Д. Натансом. В соответствии с ней названия ферментам дают по тем бактериям, из которых они были выделены.
Первая буква названия обозначает род микроорганизма, две следующие — его вид; далее идет порядковый номер данной рестриктазы в ряду других эндонуклеаз, выделенных из данного организма. Например: рестриктазы Нра I, Нра II — ферменты, выделенные из Haemophilus parainfluenzae; Eco RI — рестриктаза, выделенная из Е. coli. Иногда вставляют еще одну, четвертую, латинскую букву — как указатель штамма бактерий: Hind III — из Haemophilus influenzae. Если защитная система бактериальной клетки (система рестрикции — модификации) локализована в плазмиде, то указывают символ плазмиды — R, например: Eco RI.
Естественной функцией рестриктаз является защита бактерии от чужеродной ДНК (прежде всего от ДНК бактериофагов, которая может проникнуть в клетку и вызвать ее трансформацию). Они ограничивают возможность размножения фаговой ДНК, разрезая ее на части. Фермент рестрикции не может разрезать свою собственную ДНК, так как бактериальная ДНК модифицирована метилированием, осуществляемым ферментом ДНК-метилазой.

Рис. 4.3. Образование в ДНК «тупых» (а) и «липких» (б) концов под действием рестриктаз (по А.С. Коничеву и Г.А. Севастьяновой, 2003)
Определенные рестрикта- зы узнают в ДНК последовательности из нескольких (от четырех до восьми) нуклеотидов, осуществляя либо несимметричные, либо симметричные разрывы. При расщеплении молекула ДНК разрезается с образованием так называемых «липких» или «тупых» концов (рис. 4.3). «Липкие» концы образуются, когда разрывы в разных цепочках ДНК происходят со смещением друг относительно друга (рестрик- тазы Eco RI; Hind III), а «тупые» — когда разрывы в цепочках возникают друг против друга (рестриктазы Taq I; Нра I; Sma I). В настоящее время выделено свыше 2000
рестриктаз, которые могут узнавать более 150 сайтов рестрикции.
Обратные транскриптазы, ДНК-полимеразы — ферменты, синтезирующие ДНК на матрице ДНК. В генетической инженерии часто используется ДНК-полимераза I, выделенная А. Корнбергом и сотрудниками в 1958 г. из клеток Е. coli. Этот фермент имеет трехдоменную структуру. При удалении N-концевого домена оставшаяся часть молекулы (фрагмент Кленова) сохраняет характерные для нее каталитические свойства. ДНК-полимераза в естественных условиях в клетке играет важную роль в репарации (восстановлении структуры) поврежденной ДНК, осуществляя так называемую ник-трансляцию (ник — разрыв в одной из цепей ДНК).
РНК-зависимая ДНК-полимераза, ревертаза — это ферменты, которые используют для синтеза комплементарной цепи ДНК с мРНК. Впервые их выделили Г. Темин и С. Ми- зутани в 1970 г. из вируса саркомы Рауса. Полученную двухцепочечную комплементарную молекулу ДНК (кДНК) можно затем встраивать в векторы, размножать в составе гибридных молекул ДНК и использовать для дальнейших исследований. Таким способом можно создавать кДНК-биб- лиотеки. Следует отметить, что молекулы кДНК не содержат интронов, что позволяет клонировать ДНК эукариот в прокариотических системах.
Лигазы — ферменты, которые «сшивают» фрагменты ДНК за счет фосфодиэфирных связей, образующихся между З’-гидроксильной концевой группой одного фрагмента ДНК и 5′-фосфатной группой другого фрагмента.
Из двух типов существующих лигаз для лигирования фрагментов ДНК обычно используют более универсальную лигазу фага Т4, которая может «сшивать» как «липкие», так и «тупые» концы. ДНК-лигазы необходимы в естественных условиях в процессах репарации ДНК и репликации — при удвоении цепи ДНК.
Ферменты, изменяющие строение концов фрагментов ДНК. Например, щелочная фосфатаза отщепляет от линейного фрагмента молекулы ДНК 5′-фосфатные группировки, что значительно снижает, количество образующихся случайных, нежелательных комбинаций фрагментов ДНК (в том числе тех, которые могут образоваться под действием ДНК-лигазы). Нуклеаза Ва1 31 — это фермент, неспецифически удаляющий нуклеотиды из последовательности ДНК. Он позволяет «подтупить» несимметричные концы ДНК либо укоротить фрагменты ДНК, сближая их функционально значимые элементы.
Источник: studme.org