2 Ноября 2020 Производство вакцин – многоступенчатый, длительный процесс, который требует участия тысяч человек и серьезных материальных вложений. Его стандарт был разработан в середине XX века. На сегодняшний день в мире зарегистрировано около 100 вакцин, и ученые накопили достаточно опыта, чтобы быстро отреагировать и разработать новый препарат в случае критической ситуации.
С чего все начинается
Вакцины не разрабатываются просто так, по чьему-либо желанию. Процесс инициируется, когда инфекция приобретает угрожающий характер (эпидемии или пандемии), особенно всемирного масштаба. Огромное количество накопленных статистических данных служит толчком к поиску нового препарата.
В разработке принимают участие ученые разных направлений – вирусологи, биологи, иммунологи, бактериологи и другие. И на первом этапе им необходимо не только выявить возбудителя и «опознать» его, но и тщательно изучить особенности жизнедеятельности, генетического материала, антигенов. Более того, перед исследователями стоит задача понять, как организм отвечает на проникновение микроба, какие иммунные механизмы задействованы.
Почему в детской клинике «Фэнтези» дети не плачут?
Изучение свойств патогена происходит как в условиях лаборатории (с привлечением животных или in vitro), так и путем непосредственного наблюдения за инфицированными людьми.
in vitro – это технология выполнения опытов «в пробирке», т.е. вне живого организма.
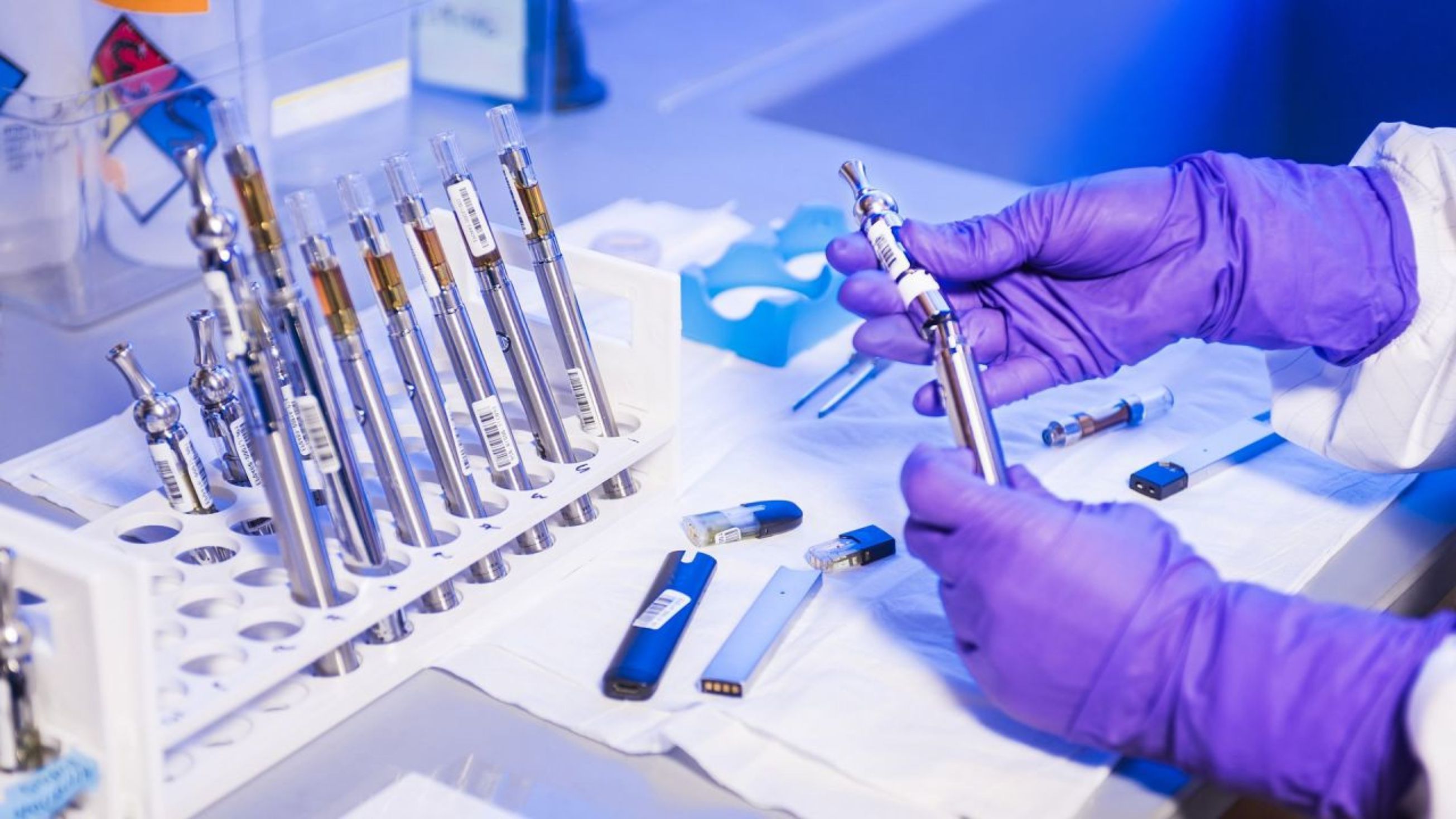
В процессе принимают участие одновременно несколько групп ученых, каждая из которых имеет свои задачи и методы. Таким образом, инфекционного возбудителя исследуют с максимального числа сторон.
Здесь же формируются гипотезы, каким может быть будущий препарат, – живой, инактивированный, синтетический. Важными моментами являются, например:
- как будет происходить оценка иммунного ответа;
- какие антигены возбудителя нужно взять;
- какая питательная среда потребуется для выращивания микроорганизма;
- сколько антигена надо, чтобы стимулировать формирование иммунитета у людей разных возрастов;
- сколько дозировок нужно и с какой периодичностью введения, и так далее.
НА ЗАМЕТКУ! Антиген – часть инфекционного возбудителя, к которому иммунная система вырабатывает защитные антитела. Для разных антигенов (даже одного микроба) нужны разные антитела.
То есть, на этапе разработки вакцин ученые сталкиваются с огромным количеством вопросов, выдвигают и проверяют десятки и сотни гипотез, при необходимости меняют концепцию. Понятно, что в экстренных случаях такая работа ведется непрерывно, круглосуточно, и в ней задействовано в несколько раз больше исследований, чем в штатном режиме.
НА ЗАМЕТКУ! Возникает вопрос: почему бы тогда не создать одну вакцину, например, от гриппа, и делать прививку каждый год, не вспоминая об этом заболевании? Дело в том, что вирус гриппа постоянно мутирует, свойства антигенов изменяются, и ученым приходится ежегодно создавать новые препараты. Но это не значит, что новую вакцину делают «наугад».
ВОЗ располагает сетью специализированных центров, в которых происходит сбор данных о вспышках гриппа по всему миру. Ученые непрерывно анализируют штаммы, выявляют новые разновидности, проводят антигенные исследования. То есть, состав будущего препарата обоснован конкретными фактами.
Более подробно о вакцине от гриппа можно почитать в нашей статье: « Вековая война с гриппом: про вакцины от начала до наших дней». К слову, другая ситуация с ВИЧ. Мутации этого вируса происходят в несколько раз чаще, чем гриппа. «Уловить» изменения на данный момент исследователи не могут, поэтому вакцины от него нет.
Немецкие медработники не спешат делать прививки от COVID-19
Доклинический этап
Когда базовые исследования закончены, и прототип препарата готов, начинается доклинический этап. Испытания проводятся на животных, параллельно отрабатывается технология производства вакцины.
Среди важных моментов доклинических испытаний можно отметить следующие:
- происходит оценка возможности вакцины формировать иммунитет;
- выявляется токсичность препарата для живого организма;
- определяется минимальная, оптимальная и максимально допустимая дозировка;
- исследуется воздействие на плод (вероятность развития аномалий и прочее);
- оценивается способность препарата влиять на образование и/или рост опухолей;
- оцениваются аллергизирующие свойства и так далее.
В процессе тестирования животным вводят вакцину в различных концентрациях и в разных состояниях организма, наблюдая и фиксируя при этом малейшие изменения. Нужно отметить, что большая часть вакцин не проходит доклинические испытания, так как не приводит к цели – иммунный ответ на введение отсутствует.
НА ЗАМЕТКУ! Для проведения доклинических исследований, как правило, берут два вида животных. Чаще всего, это – мыши и приматы. Идеальный вариант – когда в тестировании принимают участие от трех и более видов. Это дает возможность подобрать оптимально подходящую дозировку и обеспечить полную безопасность препарата.
Если доклинические испытания прошли успешно, для дальнейших испытаний нужно получить разрешение в специализированных органах. Авторы подают заявку, в которой подробно описываются проведенные исследования и тесты, обосновывается необходимость применения препарата и другие моменты. В ответ получают либо отказ, либо разрешение. При положительном решении разработка вакцины переходит в клинический этап.
ЭТО ИНТЕРЕСНО! Своеобразные «прививки» от оспы делали в Китае в 15 веке. У больного человека брали струпья, растирали в порошок и давали вдыхать здоровому. Среди других вариантов «вакцинации» – надетое на здорового человека белье инфицированного или вкладывание в ноздри ватного тампона, пропитанного гнойным содержимым язв. Какими бы варварскими не казались нам эти методы сейчас, в то время они реально помогали!
Клинический этап разработки
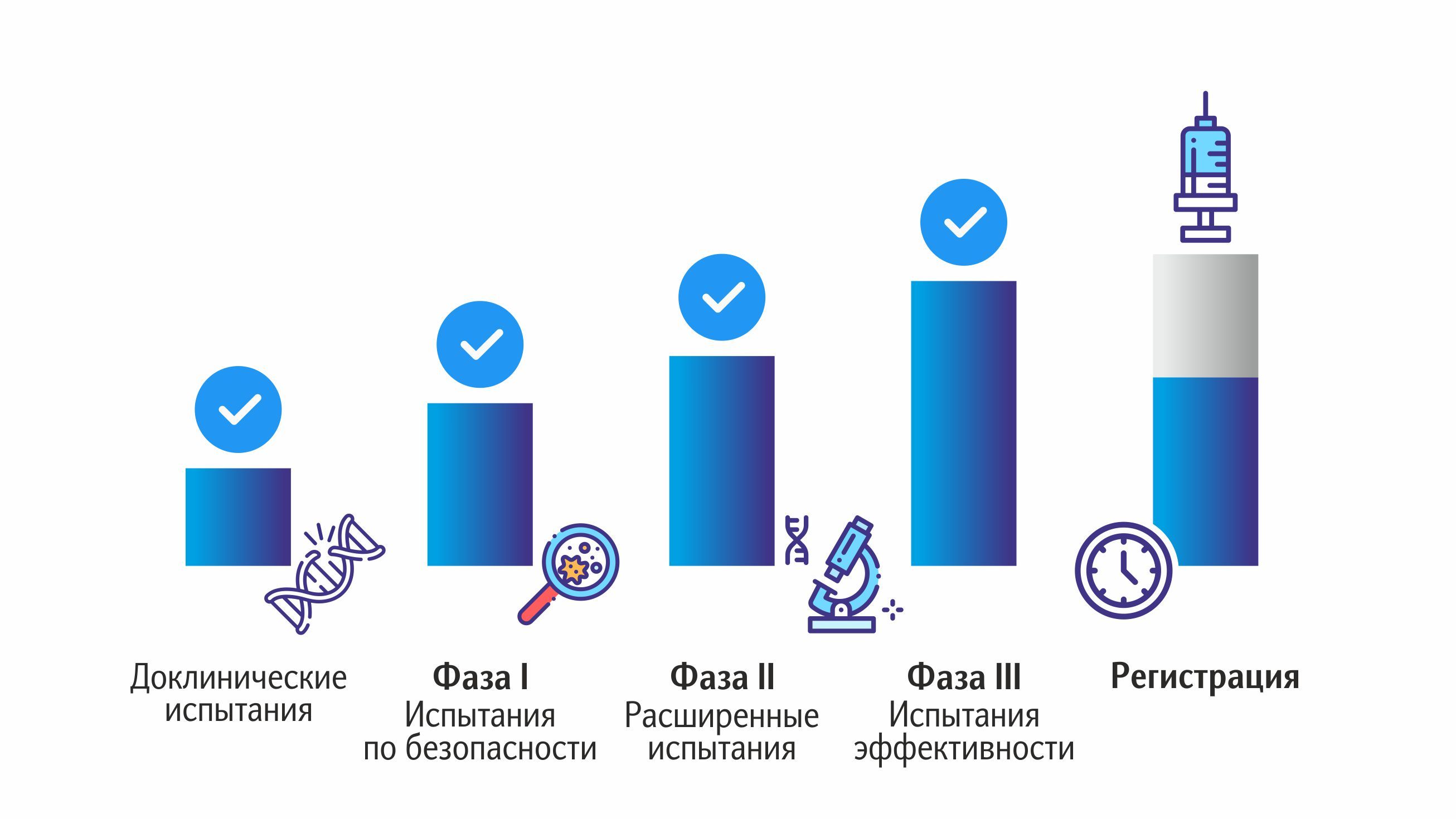
Этот этап предполагает непосредственное участие в испытаниях людей-добровольцев. Неважно, для какого возраста разрабатывается вакцина, ее действие изучают только на здоровых взрослых людях. Клинические исследования проводятся в три фазы. Процесс разделен на стадии, что позволяет контролировать тестирование препарата, постепенно увеличивая количество людей.
Это значительно снижает риски: всё что будет тестироваться массово, уже прошло испытания в узких кругах. И, конечно, такой подход позволяет прекратить тестирование на любом этапе в случае обнаружения нежелательных явлений. Именно поэтому каждая фаза имеет огромную значимость и свои цели.
Первая фаза
Проводится на совсем небольшом количестве людей (десятки людей). Её цель – подтверждение первичной безопасности для людей в принципе. Происходит исследование вакцины в действии. Ученые обращают внимание на следующие моменты:
- переносимость и побочные явления;
- особенность иммунного ответа (скорость, выраженность и другие);
- взаимодействие с другими препаратами;
- безопасность диапазона доз.
В процессе тестирования может изменяться не только дозировка, но и состав препарата. Вакцину вводят не сразу всем участникам, а поочередно, чтобы избежать массовых негативных проявлений в случае, если что-то пойдет не так.
Вторая фаза
Цель этой стадии – оценка эффективности (иммуногенности) вакцины. Во второй фазе испытаний принимает участие несколько сотен добровольцев. На данном этапе происходит еще большая отработка свойств и дозировки препарата. Тщательно фиксируются и анализируются реакции организма, определяется периодичность и сроки вакцинации, особенности транспортировки и прочие моменты.
Третья фаза
Её цель – доказать безопасность и эффективность вакцины при массовом применении в динамике, а также удостовериться, что польза вакцины компенсирует те нежелательные реакции, которые неминуемо будут выявлены (хотим уточнить, что допускаются лишь легкие реакции). Именно на третьей фазе ученые делают выводы, которые невозможны при небольшой численности испытуемых: действие вакцины изучается на тысячах человек. Анализируется частота побочных эффектов (в том числе отдаленных), продолжается определение безопасности.
После того, как все фазы клинического этапа исследований успешно пройдены, данные о них поступают в специализированные структуры. Положительное решение означает, что вакцина может быть запущена в производство; препарат регистрируют, а фирме-изготовителю выдается соответствующая лицензия.
Нужно отметить, что лицензируется не только сама вакцина, но и ее производство. Если в процесс изготовления вносятся какие-либо изменения или он не может в полной мере обеспечить качество, препарат заново проходит испытания. Вакцины выпускаются сотнями тысяч дозировок, и важно, чтобы каждая из них соответствовала ранее заявленным протоколам.
Дальнейшая «жизнь» вакцины
Выдача лицензии и массовый выпуск вакцины не означает, что исследования закончились. Существует еще четвертая фаза клинических исследований. Она проводится уже после того, как препарат становится доступным для людей через розничную сеть медицинский организаций. Это постмаркетинговые испытания или так называемый постклинический мониторинг.
Он имеет масштабный характер, позволяют получить еще более подробную информацию о безопасности и эффективности препарата. Также на четвертой фазе оцениваются комбинации с другими препаратами и уточняются вновь открывшиеся данные и гипотезы.
Может быть и такое: вакцину зарегистрировали и начали применять, но внезапно сняли с производства. Дело в том, что даже несколько тысяч человек в некоторых случаях не могут являться абсолютным показателем безопасности. Только внедрение в массы способно в полной степени проявить те или иные качества препарата. Однако такие случаи – редкость.
Примечательно, что даже после того, как все фазы испытаний пройдены, наблюдения за действием препарата продолжают вестись постоянно в течение многих лет: ученые отслеживают влияние на организм в долгосрочном отношении, анализируют данные о динамике заболевания с момента внедрения препарата.
Как же получают сами препараты?
Непосредственное производство вакцины зависит от ее вида. В общих чертах его можно описать следующим образом.
1. Живая вакцина (ослабленная)
- Выбирают штамм возбудителя.
- Ослабляют микроорганизм.
- Размножают (культивируют) в питательной среде.
- Очищают от примесей.
- Стандартизируют (приводят к нужной концентрации, фасуют).
2. Инактивированная вакцина (убитые возбудители).
3. Рекомбинантная вакцина. Используются методы генной инженерии.
- У патогенного возбудителя берут часть генетического материала.
- Встраивают его в геном клеток, которые будут его производить (чаще всего, это – дрожжи).
- Культивируют клетки в питательной среде.
- Выделяют и очищают антиген.
- Готовят вакцину.
Кроме этого, существуют и другие способы производства вакцин, инновационные и дорогостоящие, например, полное воссоздание вируса искусственным путем. Иммунитет реагирует на него, как на «живого», но вероятность заражения нулевая, так как в такой частице отсутствует геном.
НА ЗАМЕТКУ! Одни из последних разработок ученых – создание вакцин на основе растительных вирусов. Их комбинируют с антигеном возбудителя болезни человека. Подобные исследования с использованием вируса табачной мозаики уже проводятся в отношении краснухи, COVID, сибирской язвы.
Сколько времени требуется для создания препарата
Длительность разработки и производства вакцин зависит от многих факторов: штамма возбудителя, антигенных свойств, того, насколько он изучен. В среднем, этапы занимают следующее количество времени:
Суммарно на разработку одной вакцины уходит примерно 10-15 лет (без мониторинга на практике после внедрения в производство).
В ряде ситуаций допускается экстренный выпуск препаратов. Однако это не означает, что они «не проверены». В любом случае вакцина проходит установленные протоколом этапы, но в очень сокращенном варианте. В качестве примера можно взять COVID-19 или вирус Эбола.
То же происходит, если свойства, присущие семейству возбудителя, хорошо известны. Например, ежегодные мутации вируса гриппа не являются препятствием для быстрого производства новой вакцины.
Особенности контроля
Каждый этап производства вакцин жестко контролируется. Стандарты и положения, регулирующие нормы качества препаратов, изложены в сборнике – фармакопее. Она имеет юридическую силу и находится под государственным контролем.
Люди-добровольцы, которые участвуют в испытаниях, обязательно должны дать на это свое согласие на основании утвержденного этическим комитетом протокола. Непосредственно на производстве надзору подвергается каждая серия выпущенного препарата. Контролируется не только состав вакцины, но и стерильность, концентрация, требования к фасовке, упаковке и так далее.
На фоне вышесказанного утверждения противников вакцинации выглядят, по меньшей мере, смешными. А если вы запутались в современных вакцинах, раздумываете – делать прививки или нет, наши специалисты всегда придут на помощь: проконсультируют, объяснят, посоветуют.
Источник: asko-med.ru
Как действуют вакцины?
Данная статья входит в серию публикаций, посвященных разработке и распределению вакцин. Узнайте больше о вакцинах, о принципах их действия и о том, как обеспечивается их безопасность и справедливое распределение, в серии публикаций ВОЗ «Все о вакцинах».
Микробы находятся рядом с нами, как в окружающей среде, так и в нашем организме. Когда восприимчивый человек сталкивается с вредным микроорганизмом, это может привести к заболеванию и смерти.
У организма человека есть много способов защиты от патогенов (болезнетворных микроорганизмов). Кожа, слизь и реснички (микроскопические волоски, удаляющие чужеродные частицы из легких) выполняют роль физических барьеров, которые в первую очередь препятствуют проникновению патогенов в организм.
Когда патоген инфицирует организм, срабатывают его защитные механизмы, называемые иммунной системой, которые атакуют и разрушают патоген, либо же он преодолевает их.
Естественный ответ организма
Патоген — это бактерия, вирус, паразит или грибок, который может вызвать заболевание внутри организма. Каждый патоген состоит из нескольких элементов, обычно уникальных для этого конкретного патогена и заболевания, которое он вызывает. Элемент патогена, вызывающий образование антител, называется антигеном.
Антитела, образованные в ответ на антиген патогена, являются важной частью иммунной системы. Антитела можно считать солдатами в системе защиты нашего организма. Каждое антитело, или солдат, в нашей системе обучено распознавать один конкретный антиген. В нашем организме тысячи различных антител. Когда организм человека впервые подвергается воздействию какого-либо антигена, требуется время, чтобы иммунная система отреагировала и выработала антитела, специфические для этого антигена.
В течение этого времени человек остается восприимчивым к патогену и может заболеть.
После того, как антитела, специфические для конкретного антигена, выработаны, они начинают работать с остальной иммунной системой, чтобы уничтожить патоген и остановить болезнь. Антитела к одному патогену обычно не защищают от других патогенов за исключением случаев, когда два патогена очень похожи друг на друга, как двоюродные братья. Как только организм вырабатывает антитела в рамках своей первичной реакции на антиген, он также создает клетки памяти, вырабатывающие антитела, и эти клетки остаются живыми даже после того, как антитела уничтожат патоген. Если организм подвергается воздействию одного и того же патогена несколько раз, антитела реагируют гораздо быстрее и эффективнее, чем в первый раз, потому что клетки памяти готовы произвести антитела против этого антигена.
Это означает, что, если человек подвергнется воздействию этого опасного патогена в будущем, его иммунная система сможет отреагировать незамедлительно и защитить его от болезни.

Как помогают вакцины?
Вакцины содержат ослабленные или инактивированные частицы конкретного микроорганизма (антиген), которые вызывают иммунную реакцию внутри организма. Новые вакцины содержат программу для выработки антигенов, а не сами антигены. Независимо от того, сделана ли вакцина из самого антигена или она содержит программу для выработки организмом этого антигена, этот ослабленный вариант не вызовет болезнь у человека, получающего вакцину, но заставит его иммунную систему реагировать так, как она реагировала бы при первом воздействии данного патогена.

Для некоторых вакцин требуется введение нескольких доз с интервалом в несколько недель или месяцев. Иногда это необходимо для выработки долгоживущих антител и создания клеток памяти. Накапливая таким образом память о патогене, организм обучается бороться с конкретным болезнетворным микроорганизмом, с тем чтобы быстро уничтожить этот патоген при его воздействии в будущем.
Коллективный иммунитет
Когда человек вакцинирован, он с большой вероятностью защищен от конкретного заболевания. Но не все люди могут быть вакцинированы. Люди с нарушениями здоровья, ослабляющими их иммунную систему (например, рак или ВИЧ-инфекция), или с сильной аллергией на некоторые компоненты вакцины не могут быть вакцинированы определенными вакцинами.
Но эти люди могут быть защищены в том случае, если они живут среди вакцинированных людей. Патогену сложно циркулировать в общине, многие члены которой вакцинированы, поскольку большинство людей в общине невосприимчивы к нему. Поэтому, чем больше людей вакцинировано, тем меньше вероятность того, что люди, которые не могут быть защищены вакцинами, подвергнутся воздействию вредных патогенов. Это называется коллективным иммунитетом.
Это особенно важно для тех людей, которые не только не могут быть вакцинированы, но и могут быть более восприимчивы к болезням, против которых направлена вакцинация. Ни одна вакцина не обеспечивает 100%-ную защиту, и коллективный иммунитет не обеспечивает полную защиту тем, кто не может быть безопасно вакцинирован. Но при коллективном иммунитете эти люди будут в значительной мере защищены благодаря окружающим их вакцинированным людям.
Вакцинация защищает не только вакцинируемых людей, но и тех членов общины, которые не могут быть вакцинированы. Если у вас нет противопоказаний, вакцинируйтесь.


На протяжении истории люди успешно разрабатывали вакцины против ряда опасных для жизни болезней, включая менингит, столбняк, корь и полиомиелит.
В начале 1900-х гг. полиомиелит был распространен во всем мире, ежегодно оставляя сотни тысяч людей парализованными. К 1950 г. были разработаны две эффективные вакцины против этой болезни. Однако в некоторых частях мира вакцинация не проводилась в масштабах, достаточных для того, чтобы остановить распространение полиомиелита, особенно в Африке. В 1980-х гг. начались совместные глобальные усилия, направленные на ликвидацию полиомиелита на планете.
На протяжении многих лет и нескольких десятилетий на всех континентах проводилась вакцинация против полиомиелита в рамках регулярных посещений и кампаний массовой вакцинации. Были вакцинированы миллионы людей, в основном дети, и в августе 2020 г. африканский континент был сертифицирован свободным от полиомиелита и присоединился ко всем другим частям мира, за исключением Пакистана и Афганистана, где полиомиелит пока еще не ликвидирован.
Источник: www.who.int
Виды вакцин
Страх перед прививками во многом вызван устаревшими представлениями о вакцинах. Конечно, общие принципы их действия остались неизменными со времен Эдварда Дженнера, который в 1796 году первым применил вакцинацию от оспы. Вот только медицина с тех пор шагнула очень далеко вперед.
Так называемые «живые» вакцины, в которых используется ослабленный вирус, применяются и в наши дни. Но это лишь одна из разновидностей средств, призванных предупредить опасные болезни. И с каждым годом – в частности, благодаря достижениям генной инженерии – арсенал врачей-иммунологов пополняется все новыми видами и даже типами вакцин.
Живые вакцины
Требуют специальных условий хранения, зато обеспечивают стойкий иммунитет к болезни после одной, как правило, вакцинации. По большей части их вводят парентерально, то есть с помощью инъекций; исключение – вакцина от полиомиелита. При всех преимуществах живых вакцин, их использование связано с некоторым риском. Всегда остается шанс, что штамм вируса окажется достаточно вирулентным и станет причиной заболевания, от которого вакцинация должна была защитить. Поэтому живые вакцины не применяют на людях с иммунодефицитом (например, носителях ВИЧ, онкологических больных).
Инактивированные вакцины
Для их изготовления используются микроорганизмы «убитые» при нагревании или с помощью химического воздействия. Шансов на возобновление вирулентности нет, и потому подобные вакцины безопасней «живых». Но, разумеется, есть и оборотная сторона – более слабый иммунный ответ. То есть для выработки стойкого иммунитета требуются повторные вакцинации.
Анатоксины
Многие микроорганизмы в процессе жизнедеятельности выделяют опасные для человека вещества. Они-то и становятся непосредственной причиной заболевания, например, дифтерии или столбняка. Содержащие анатоксин (ослабленный токсин) вакцины, говоря языком медиков, «индуцируют специфический иммунный ответ». Иными словами, они призваны «научить» организм самостоятельно вырабатывать антитоксины, которые нейтрализуют вредные вещества.
Конъюгированные вакцины
Некоторые бактерии имеют антигены, которые плохо распознаются незрелой иммунной системой младенцев. В частности, это бактерии, вызывающие такие опасные заболевания, как менингиты или пневмонию. Конъюгированные вакцины призваны обойти эту проблему. В них используется микроорганизмы, хорошо распознаваемые иммунной системой ребенка и содержащие антигены, схожие с антигенами возбудителя, к примеру, менингита.
Субъединичные вакцины
Эффективны и безопасны – в них используются лишь фрагменты антигена патогенного микроорганизма, достаточные для того, чтобы обеспечить адекватный иммунный ответ организма. Могут содержать частицы самого микроба (вакцины против Streptococcus pneumoniae и против менингококка типа А). Другой вариант – рекомбинантные субъединичные вакцины, создаваемые с использованием генно-инженерной технологии. Например, вакцину от гепатита B получают путем введения части генетического материала вируса в клетки пекарских дрожжей.
Рекомбинантные векторные вакцины
Генетический материал микроорганизма, вызывающего заболевание, к которому необходимо создание протективного иммунитета, внедряется в ослабленный вирус или бактерию. Например, вирус безопасной для человека коровьей оспы используется для создания рекомбинантных векторных вакцин против ВИЧ-инфекции. А ослабленные бактерии сальмонеллы используются в качестве носителя частиц вируса гепатита B.
Источник: gutaclinic.ru