Программы химиотерапии острых лимфобластных лейкозов — схемы
Программа химиотерапии острого лимфобластного лейкоза CALGB (терапия без учета иммунофенотипа бластных клеток и групп риска)
Курс I: индукция (4 нед) Циклофосфан 1200 мг/м2 в/в в 1-й день (800 мг/м2 для больных старше 60 лет)
Даунорубицин 45 мг/м2 в/в в 1-й, 2-й, 3-й день (30 мг/м2) для больных старше 60 лет)
Винкристин 2 мг, 1-й, 8-й, 15-й, 22-й день
Преднизолон 60 мг/м2 внутрь, 1—21-й день (1—7-й день для больных старше 60 лет)
L-аспарагиназа 6000 IU/м2 подкожно, 1-й, 8-й, 11-й, 15-й, 18-й, 22-й день
Курс II: ранняя интенсификация (4 нед, повторить один раз)
Интратекально метотрексат 15 мг в 1-й день
Циклофосфан 1000 мг/м2 в/в в 1-й день
6-Меркаптопурин 60 мг/м2 внутрь, 1 — 14-й день
Цитарабин 75 мг/м2 подкожно, 1—4-й, 8—11-й день
Винкристин 2 мг в/в, 15-й, 22-й день
L-аспарагиназа 6000 IU/м2 подкожно, 15-й, 18-й, 22-й, 25-й день
Курс III: ЦНС профилактика и межкурсовая поддерживающая терапия (12 нед)
Почему погибают от лейкоза
Краниальное облучение 2400 рад, 1 — 12-й день
Интратекально метотрексат 15 мг, 1-й, 8-й, 15-й, 22-й, 29-й день
6-Меркаптопурин 60 мг/м2 внутрь, 1—70-й день
Метотрексат 20 мг/м2 внутрь, 36-й, 43-й, 50-й, 57-й, 64-й день
Курс IV: поздняя интенсификация (8 нед)
Доксорубицин 30 мг/м2 в/ в, 1-й, 8-й, 15-й день
Винкристин 2 мг в/в, 1-й, 8-й, 15-й день
Дексаметазон 10 мг/м2 внутрь, 1 —14-й день
Циклофосфан 1000 мг/м2 в/в в 29-й день
6-Тиогуанин 60 мг/м2 внутрь, 29—42-й день
Цитарабин 75 мг/м2 подкожно, 29—32-й, 36—39-й день
Курс V: длительная поддерживающая терапия (до 24 мес от момента установления диагноза)
Винкристин 2 мг в/в в 1-й день каждой 4-й недели
Преднизолон 60 мг/м2 внутрь в 1—5-й день каждой 4-й недели
6-Меркаптопурин 60 мг/м2 внутрь, 1—28-й день
Метотрексат 20 мг/м2 внутрь, 1-й, 8-й, 15-й, 22-й день
Программа химиотерапии острого лимфобластного лейкоза GMALL 04/89 (D. Hoelzer)
I. Группа стандартного риска (общий-ОЛЛ, возраст 15—35 лет, лейкоциты менее 30 тыс., ремиссия на 4-й неделе, возраст 51—65 лет)
Индукция, I фаза (1—4-я неделя терапии):
Интратекально метотрексат 15 мг в 1-й день
Даунорубицин 45 мг/м2 в/в, 1-й, 8-й, 15-й, 22-й день
Винкристин 2 мг в/в, 1-й, 8-й, 15-й, 22-й день
Преднизолон 60 мг/м2 внутрь, 1—28-й день (снижение на 5-й неделе) L-аспарагиназа 5000 Ш/м2 в/в, 15— 28-й день
Индукция, II фаза (5—8-я неделя терапии):
Циклофосфан 650 мг/м2 в/в, 1-й, 15-й, 28-й день
Цитарабин 75 мг/м2 в/в, 3—6-й, 10—13-й, 17—20-й, 24—27-й день
6-Меркаптопурин 60 мг/м2 внутрь, 1—28-й день
Интратекально в 1-й, 8-й, 15-й, 22-й день:
Метотрексат 15 мг
Цитарабин 40 мг
Дексаметазон 4 мг
Краниальное облучение 2400 рад, 1—22-й день
Ранняя консолидация (13-я, 17-я неделя):
Интратекально в 1-й день каждой указанной недели: Метотрексат 15 мг Цитарабин 40 мг Дексаметазон 4 мг Цитарабин 75 мг/м2 в/в, 1—5-й день указанных недель
Выживаемость при лейкозе — Михаил Масчан//острый лейкоз, таргетная терапия, сопроводительная терапия
Тенипозид 60 мг/м2 в/в, 1—5-й день указанных недель
Реиндукция (21—26-я неделя):
Интратекально в 1-й и 28-й день: Метотрексат 15 мг Цитарабин 40 мг Дексаметазон 4 мг
Доксорубицин 25 мг/м2 в/в, 1-й, 8-й, 15-й, 22-й день
Винкристин 2 мг в/в, 1-й, 8-й, 15-й, 22-й день
Преднизолон 60 мг/м2 внутрь, 1—28-й (снижение на 5-й неделе) Циклофосфан 650 мг/м2 в/в в 28-й день
Цитарабин 75 мг/м2 в/в, 30—33-й, 37— 42-й день
6-Тиогуанин 60 мг/м2 внутрь, 28—42-й день
Поздняя консолидация (31-я, 35-я неделя):
Интратекально в 1-й день каждой указанной недели: Метотрексат 15 мг Цитарабин 40 мг Дексаметазон 4 мг Цитарабин 75 мг/м2 в/в, 1—5-й день указанных недель
Тенипозид 60 мг/м2 в/в, 1—5-й день указанных недель
Длительная поддерживающая терапия (до 142 нед от момента установления диагноза)
6-Меркаптопурин 60 мг/м2 внутрь ежедневно
Метотрексат 20 мг/м2 внутрь или в/в 1 раз в неделю Интратекально 1 раз в 2 мес, всего 12 раз:
Метотрексат 15 мг
Цитарабин 40 мг
Дексаметазон 4 мг
II. Группа высокого риска (ранний пре-В-ОЛЛ, Ph-позитивный или BCR-ABL-позитивный ОЛЛ, а если общий ОЛЛ, то возраст 36—50 лет, лейкоциты более 30 тыс., ремиссия позже 4-й недели)
От программы терапии больных из группы стандартного риска отличается лишь программой ранней консолидации
Ранняя консолидация (13-я или 13-я, 15-я, 17-я неделя в зависимости от варианта А или Б)
А.Цитарабин 1 г/м2 2 раза в сутки в/в, 1—4-й день 13-й недели Митоксантрон 10 мг/м2 в/в, 2—5-й день 13-й недели
Б. Метотрексат 1,5 г/м2 в/в в 1-й день 13-й, 15-й, 17-й недели
L-аспарагиназа 10 000 IU/м2 в/в во 2-й день 13-й, 15-й, 17-й недели
III. Группа Т-ОЛЛ и больные с опухолевым поражением средостения
Терапия отличается от программы лечения больных из группы стандартного риска только облучением средостения в дозе 24 Гр в период проведения второй фазы индукционной терапии на 5—8-й неделе.
Программа химиотерапии острого лимфобластного лейкоза GMALL 05/93 (D. Hoelzer)
I. Группа стандартного риска (Общий-ОЛЛ, возраст 15—35 лет, лейкоциты менее 30 тыс., ремиссия на 4-й неделе, Ph-и BCR/ABL негативность)
Индукция (I и II фазы — 1—8-я неделя):
Аналогична в исследовании 04/89, но увеличена доза циклофосфана во II фазе до 1000 мг/м2
Ранняя консолидация (13-я, 15-я, 17-я неделя)
Метотрексат 1,5 г/м2 в/в в 1-й день 13-й, 15-й недели
L-аспарагиназа 10 000 Ш/м2 в/в во 2-й день 13-й, 15-й недели
Цитарабин 150 мг/м2 в/в 1 ч, 1—5-й день 17-й недели
Тенипозид 100 мг/м2 в/в 1 ч, 1—5-й день 17-й недели
6-МП 25 мг/м2 внутрь, 1—5-й день 13-й, 15-й недели
Интратекально в 1-й день 13-й и 17-й недели:
Метотрексат 15 мг
Цитарабин 40 мг
Дексаметазон 4 мг
Реиндукция (21—26-я неделя): Аналогична в исследовании 04/89, но доза циклофосфана во II фазе увеличена до 1000 мг/м2
Поздняя консолидация (33-я, 35-я, 39-я, 45-я, 47-я, 51-я неделя):
Метотрексат 1,5 г/м2 в/в в 1-й день 33-й, 35-й, 45-й, 47-й недели
L-аспарагиназа 10 000 IU/м2 в/в во 2-й день 33-й, 35-й, 45-й, 47-й недели
Цитарабин 75 мг/м2 в/в, 1—5-й день 39-й и 51-й недели
Тенипозид 60 мг/м2 в/в, 1—5-й день 39-й и 51-й недели
6-МП 25 мг/м2, 1—5-й день 33-й, 35-й, 45-й, 47-й недели
Интратекально в 1-й день 33-й, 39-й, 45-й, 51-й недели:
Метотрексат 15 мг
Цитарабин 40 мг
Дексаметазон 4 мг
6-Меркаптопурин 60 мг/м2 постоянно внутрь, 29—32-я неделя, 37-я, 38-я, 40—44-я, 50-я неделя
Длительная поддерживающая терапия (до 31-го месяца от момента установления диагноза) — ее вариант А или Б определялся рандомизацией А. 6-Меркаптопурин 60 мг/м2 внутрь ежедневно
Метотрексат 20 мг/м2 внутрь или в/в 1 раз в неделю
Интратекально в 1-й день 14-го, 16-го, 18-го, 20-го, 22-го, 24-го, 26-го, 28-го, 30-го месяца:
Метотрексат 15 мг
Цитарабин 40 мг
Дексаметазон 4 мг
Б. Так же, как А-вариант, но перерывы на последней неделе 14-го, 16-го, 20-го, 22-го, 26-го, 28-го месяца, снижение дозы до 25 мг/м2 и без введения метотрексата, 18-й, 24-й и 30-й месяц
Циклофосфан 1000 мг/м2 в/в в 1-й день 14-го, 20-го, 26-го месяца
Цитарабин 500 мг/м2 24-часовая инфузия в 1-й день 14-го, 20-го, 26-го месяца
Цитарабин 150 мг/м2 в/в, 1—5-й день 16-го, 22-го, 28-го месяца
Тенипозид 100 мг/м2 в/в, 1—5-й день 16-го, 22-го, 28-го месяца Метотрексат 1,5 г/м2 в/в, 1-й, 15-й день 18-го, 24-го, 30-го месяца
L-аспарагиназа 10 000 IU/м2 в/в, 2-й, 16-й день 8-го, 24-го, 30-го месяца 6-МП 25 мг/м2 внутрь, 1—5-й, 15— 19-й день 18-го, 24-го, 30-го месяца
II. Группа высокого риска (общий-ОЛЛ при возрасте старше 35, моложе 55 лет, лейкоциты более 30 тыс., ремиссия на 8-й неделе, ранний пре-В, Ph-положительный ОН) Индукция (1 фаза — 1—4-я неделя)
Аналогична таковой в исследовании 04/89
Индукция (11 фаза — курс НАМ — 5-я неделя):
Цитарабин 3 г/м2 2 раза в сутки 3-часовая в/в инфузия в 1—4-й день 5-й недели
Митоксантрон 10 мг/м2 в/в 1 раз в день 30 мин, 3—5-й день
Ранняя консолидация (13-я, 15-я и 17-я неделя):
Метотрексат 1500 мг/м2 24-часовая инфузия в 1-й день 13-й, 15-й недели Лейковорин, первое введение 30 мг/м2 через 18 ч после метотрексата, затем 15 мг/м2 через 6 и 12 ч после первого введения лейковорина (эта схема рассчитана на только стандартные концентрации метотрексата в сыворотке крови, поэтому для точной дозировки лейковорина целесообразно измерять концентрацию метотрексата) L-аспарагиназа 10 000 ед/м2 в/в, 2-й день 13-й, 15-й недели 6-Меркаптопурин 25 мг/м2 внутрь 1 — 5-й день 13-й, 15-й недели Циклофосфан 1000 мг/м2 в/в в 1-й день 17-й недели
Цитарабин 500 мг/м2 24-часовая инфузия в 1-й день 17-й недели
Интратекально в 1-й день 17-й недели:
Метотрексат 15 мг
Цитарабин 40 мг
Дексаметазон 4 мг
Реиндукция (21—-26-я неделя): Аналогична таковой для группы стандартного риска
Поздняя консолидация (33-я, 39-я, 45-я, 51-я неделя):
Цитарабин 3 г/м2 2 раза в день 3-часовая в/в инфузия в 1—4-й день 33-й недели
Митоксантрон 10 мг/м2 в/в 30 мин 1 раз в день, 3—5-й день 33-й недели
Метотрексат 1500 мг/м2 24-часовая инфузия, 1-й, 15-й день 39-й недели
Лейковорин 30 мг/м2 через 18 ч после метотрексата, 15 мг/м2 через 6 и 12 ч после первого введения лейковорина (эта схема рассчитана только на стандартные концентрации метотрексата в сыворотке крови, поэтому целесообразно измерять концентрацию метотрексата)
L-аспарагиназа 10 000 ед/м2 в/в, 2-й, 16-й день курса
6-Меркаптопурин 25 мг/м2 внутрь, 1— 5-й день, 15— 19-й день курса
Циклофосфан 1000 мг/м2 в/в в 1-й день 45-й недели
Цитарабин 500 мг/м2 24-часовая инфузия в 1-й день
Тенипозид 100 мг/м2 в/в 1 ч, 1—5-й день 51-й недели
Цитарабин 150 мг/м2 в/в 1 час, 1—5-й день 51-й недели
Длительная поддерживающая терапия (до 31-го месяца от момента установления диагноза)
Аналогична таковой для группы стандартного риска
* Для Ph-позитивных ОЛЛ — Гливек 400 мг в период II фазы индукции, затем — ТКМ
III. Терапия Т-клеточных острых лейкозов
Аналогична программе для группы стандартного риска, за исключением трех моментов:
1) во II фазу индукции (5—8-я неделя) включено еще и облучение средостения в дозе 24 Гр
2) ранняя консолидация (13-я, 17-я, 19-я неделя)
Цитарабин 1 г/м2 2 раза в день 3-часовая в/в инфузия, в 1—4-й день 13-й недели
Митоксантрон 10 мг/м2 в/в 30 мин 1 раз в день, 3—5-й день 13-й недели Метотрексат 1,5 г/м2 в/в постоянная инфузия 1-й день 17-й, 19-й недели
L-аспарагиназа 10 000 IU/м2 в/в во 2-й день 17-й, 19-й недели
3) поздняя консолидация (33-я, 39-я, 45-я, 51-я неделя)
Циклофосфан 1000 мг/м2 в/в в 1-й день 33-й, 45-й недели
Цитарабин 500 мг/м2 24-часовая инфузия в 1-й день 33-й, 45-й недели
Цитарабин 150 мг/м2 в/в, 1—5-й день 39-й и 51-й недели
Тенипозид 100 мг/м2 в/в, 1—5-й день 39-й и 51-й недели
Интратекально в 1-й день 33-й, 39-й, 45-й, 51-й недели:
Метотрексат 15 мг
Цитарабин 40 мг
Дексаметазон 4 мг
IV. Терапия В-зрелоклеточных острых лейкозов
Терапия основывается на программах лечения В-зрелоклеточных лейкозов / лимфом у детей ALL/NHL-BFM 90
Предфаза (1-я неделя) Циклофосфан 200 мг/м2 в/в 1 ч, 1—5-й день
Преднизолон 60 мг/м2 внутрь, 1—5-й день
Блок А (2-я, 8-я, 14-я неделя):
Винкристин 2 мг в/в в 1-й день
Метотрексат 3 гр/м2 в/в 24-часовая инфузия (лейковорин вводится по схеме, описанной выше) в 1-й день
Ифосфамид 800 мг/м2 в/в 1 ч, 1—5-й день
Тенипозид 100 мг/м2 в/в 1 ч, 4-й, 5-й день
Цитарабин 150 мг/м2 2 раза в день 1 ч, 4-й, 5-й день
Дексаметазон 10 мг/м2 внутрь, 1—5-й день
Интратекально в 1-й и 5-й день:
Метотрексат 15 мг
Цитарабин 40 мг
Дексаметазон 4 мг
Блок Б (5-я, 11-я, 17-я неделя)
Винкристин 2 мг в/в в 1-й день
Метотрексат 3 гр/м2 в/в 24-часовая инфузия в 1-й день (лейковорин вводится по схеме, описанной выше)
Циклофосфамид 200 мг/м2 в/в 1 ч, 1—5-й день
Адриамицин (доксорубицин) 25 мг/м2 в/в, 4-й, 5-й день
Дексаметазон 10 мг/м2 внутрь, 1—5-й день
Интратекально в 1-й и 5-й день:
Метотрексат 15 мг
Цитарабин 40 мг
Дексаметазон 4 мг
При завершении 6 блоков больные снимаются с терапии. В случае отсутствия ремиссии после проведения блоков А, Б, А (трех в общей сложности) выполняют программу блока С (2 раза для оценки эффекта). При достижении ремиссии с помощью такой терапии блок С повторяют еще 2—4 раза. Эти больные являются кандидатами на выполнение аутологичной ТКМ.
Блок С
Виндезин 3 мг в/в 1-й день
Цитарабин 2 г/м2 3-часовая инфузия 2 раза в день, 1-й, 2-й день
Тенипозид 150 мг/м2 в/в, 3-й, 4-й, 5-й день
Дексаметазон 10 мг/м2 внутрь, 1—5-й день
Интратекальные введения не возобновляются
Программа химиотерапии острого лимфобластного лейкоза Hyper — CVAD (М. D. Anderson Cancer Research Center)
Программа терапии рецидивов и резистентных форм ОЛЛ (может быть использована для первичных больных) Проводится 8 курсов химиотерапии, чередующихся между собой. Длительность лечения 6 мес
Курсы 1-й, 3-й, 5-й, 7-й:
Циклофосфамид 300 мг/м2 в/в 2 раза в день, 1—3-й день
Винкристин 2 мг в/в, 4-й, 11-й день Доксорубицин 50 мг/м2 в/в в 4-й день Дексаметазон 40 мг в день внутрь, 1— 4-й и 11—14-й день.
Курсы 2-й, 4-й, 6-й, 8-й (начинают сразу после завершения 1-го, 3-го, 5-го, 7-го, если нет депрессии кроветворения. Если есть цитопения, то с 1-го дня перерыва после 1-го, 3-го, 5-го, 7-го курсов начинается ведение Г-КСФ)
Метотрексат 1 г/м2 24-часовая инфузия в 1-й день
Лейковорин 15 мг/м2 через 12, 18, 24 ч после метотрексата
Цитарабин 3 г/м2 2 раза в день 3 ч во 2-й и 3-й день.
На 4-й день начинается введение Г-КСФ в дозе 5 мкг/кг до восстановления показателей периферической крови (нейтрофилов более 1000 в 1 мкл). После нормализации анализов периферической крови возобновляется терапия — проводят курс 3-й, или 5-й, или 7-й.
Выполнение программы без ростовых факторов сопряжено с очень высоким риском развития тяжелых осложнений
Программа химиотерапии острого лимфобластного лейкоза RACOP (ГНЦ РАМН)
Программа терапии рецидивов и рефрактерных форм ОЛЛ (может быть использована в качестве консолидации у больных из группы риска):
Даунорубицин 45 мг/м2 в/в, 1—3-й день
Цитарабин 100 мг/м2 2 раза в день, 1—7-й день
Циклофосфамид 400 мг/м2 1 раз в день, 1—7-й день
Винкристин 2 мг в/в, 1-й, 7-й день
Преднизолон 60 мг/м2, 1—7-й день внутрь
После проведения двух полнодозных курсов выполняют один курс с дозой циклофосфана 200 мг/м2 и одним введением винкристина, затем выполняют программу поддержания ремиссии по схеме чередования курсов RACOP (5-дневный) — СОАР — СОМР, проводимых с интервалом 1 мес в течение 3 лет от момента начала терапии.
RACOP 5-дневный:
Даунорубицин 45 мг/м2 в/в, 1-й, 2-й день
Цитарабин 100 мг/м2 2 раза в день, 1—5-й день
Циклофосфамид 200 мг/м2 1 раз в день, 1—5-й день
Винкристин 2 мг в/в в 1-й день
Преднизолон 60 мг/м2 внутрь, 1—5-й день
СОАР:
Циклофосфан 400 мг/м2 в/в в 1-й день
Винкристин 2 мг в/в в 1-й день
Цитарабин 60 мг/м2 2 раза в день в/в, 1—5-й день
Преднизолон 40 мг внутрь, 1—5-й день
СОМР:
Циклофосфан 1000 мг/м2 в/в в 1-й день
Винкристин в/в 2 мг в 1-й день
Метотрексат 12,5 мг/м2 в/в, 3-й, 4-й день
Преднизолон 100 мг внутрь, 1—5-й день
Программа химиотерапии острого лимфобластного лейкоза HiDexa (ГНЦ РАМН)
Программа терапии рецидивов и рефрактерных форм ОЛЛ
Адриабластин (доксорубицин) 25 мг/м2, 1-й, 8-й, 15-й день
Винкристин 2 мг, 1-й, 8-й, 15-й день
L-Аспарагиназа 15 тыс. ед/м2, 1-й, 8-й, 15-й день
Дексаметазон 50 мг/м2 в/в, 1—7-й день 25 мг/м2 в/в, 8—15-й день (затем снижение в течение недели)
Если достигается ремиссия, программа повторяется 2 раза (доза дексаметазона в 1-ю неделю 25 мг/м2, во 2-ю — 10 мг/м2), затем начинается терапия поддержания ремиссии по программам СОАР — СОМР, в которых преднизолон заменен на дексаметазон в дозе 10 мг/м2.
Все больные с резистентными формами и рецидивами ОЛЛ, у которых достигнута ремиссия, являются потенциальными кандидатами на выполнение трансплантации костного мозга (аллогенного или аутологичного).
Программа химиотерапии острого лимфобластного лейкоза VAD
Программы терапии острого плазмобластного лейкоза
Винкристин 0,4 мг в день в/в 24-часовая инфузия, 1—4-й день
Адриабластин 10 мг/м2 в день в/в 24-часовая инфузия, 1—4-й день
Дексаметазон 40 мг в день внутрь, 1— 4-й день, 11 —14-й день
Курсы повторяются по мере восстановления показателей периферической крови. Если достигнута ремиссия, терапия может продолжаться 1 год и более
Программа химиотерапии острого лимфобластного лейкоза высокими дозами циклофосфана
Циклофосфан 7 г/м2 с последующим введением Г-КСФ в дозе 5 мкг/кг (2 курса)
После проведения двух курсов ВДЦ возможно осуществление трансплантации аутологичных стволовых клеток периферической крови с последующей поддерживающей терапией ИНФ-а в дозе 3 млн ЕД в день подкожно через день в течение 3 лет.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Преодоление лекарственной устойчивости при остром лейкозе — моноклональная антитела
- Новые методы трансплантации костного мозга в лечении острого лейкоза
- Программы химиотерапии острых лимфобластных лейкозов — схемы
- Программы химиотерапии острых миелоидных лейкозов — схемы
- Программы химиотерапии острых промиелоцитарных лейкозов — схемы
- Что такое миелодиспластический синдром (МДС)? — история изучения
- Эпидемиология миелодиспластических синдромов (МДС) — заболеваемость
- Клональность миелодиспластических синдромов (МДС) — клональная теория
- Этиология миелодиспластических синдромов (МДС) — причины
- Мутации генов при миелодиспластических синдромах
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Источник: meduniver.com
Химиотерапия при лейкозе
![]()
Хроническая лейкоцитарная лейкемия считается одним из наиболее распространенных видов этого заболевания в течение последних нескольких десятков лет. Обнаружить его можно только в ходе лабораторных анализов крови, обратив внимание на повышение уровня белых кровяных телец. Точный диагноз удается поставить только после получения результатов еще одного обследования – проточной цитометрии. Возможно направление пациента на дополнительные анализы с целью провести дифференцированную диагностику и точно узнать характер и причины патологии.
Химиотерапия острого лейкоза
В перечень основных методов лечения лейкемии входит химиотерапия – воздействие на патогенные клетки агрессивных химических веществ, буквально уничтожающих ткани опухоли. Однако у данной методики есть одно существенное ограничение – неэффективность применения на начальной стадии заболевания, когда цитостатики не могут уничтожить незрелые клетки опухолевого процесса. Поэтому на ранних этапах специалисты выбирают альтернативные формы лечения, позволяющие замедлить развитие патологии, а на ее более поздних стадиях предпочитают использовать химиотерапевтические технологии.
Сегодня химиотерапия при лейкозе у взрослых признана одним из основных способов лечения онкологических заболеваний крови. Единственное условие – точный подбор препаратов и их дозировки с учетом ряда факторов:
- Оптимальная схема намеченных процедур.
- Подходящая длительность курса.
- Вид онкологического заболевания.
- Общее состояние организма пациента, его возраст и т.д.
Лечение острого лимфобластного лейкоза методом химиотерапии имеет свои характерные особенности:
- Для наиболее эффективного воздействия на патогенные группы тканей специалисты предпочитают назначать так называемую полихимиотерапию, когда пациентам назначается одновременное введение нескольких химических препаратов с различным направлением действия.
- В ходе острой стадии болезни лечение проводится в стационаре, при хроническом течении онкологии курс для взрослых можно проходить амбулаторно. Одновременно пациенту назначается регулярный мониторинг показателей крови для оценки эффективности назначенного курса.
При условии грамотного проведения лечения злокачественных патологий методом химиотерапии удается добиться уменьшения размеров новообразования в структуре органов системы кроветворения. Это объясняет, почему лечение назначается перед пересадкой костного мозга. Только так удается повысить шанс на успешное приживление биоматериала и его способность победить опасное заболевание.
Как проходит химиотерапия при лейкозе?
В зависимости от результата исследований организма пациента с ОЛЛ (острым лимфобластным лейкозом) или ОМЛ (острым миелоидным лейкозом) ему назначается один из следующих видов химиотерапии:
Конкретный вид курсов химиотерапии при лейкозе препаратами-цитостатиками зависит от особенностей организма, стадии развития заболевания и прочих факторов. Часто выбор технологии проведения химиотерапии зависит от результатов лабораторных анализов пациента. Именно они помогают четко выбрать оптимальную дозировку, схему и длительность курса введения препаратов.
При выборе курса химиотерапии при лейкозе как основного метода лечения онкологических заболеваний крови пациенту назначают прием или введение трех типов препаратов – антагониста пуринов, антител анти-CD20 и так называемого алкилирующего состава, сочетание которых рассчитывается в индивидуальном порядке. Одновременно назначается терапия для поддержания и стимуляции остальных органов и систем организма. Противопоказания для данного направления лечения – наличие у пациента генетических патологий, преклонный возраст, заболевания почек и других внутренних органов, из-за чего дополнительное медикаментозное воздействие может дать негативную побочную реакцию.
Показания к проведению химиотерапевтических мероприятий
Прохождение курса химиотерапии рекомендовано пациентам в следующих случаях:
- Перед операцией по трансплантации костного мозга.
- При симптомах онкологической интоксикации.
- При поражении клеток костного мозга – анемии, лейкоцитозе, тромбоцитопении, нулевой реакции организма на введение глюкокортикостероидов и т.д.
Риски при проведении химиотерапии при онкопатологии крови
Основная задача, которую позволяет решить химиотерапия, — приостановка развития мутирующих клеток и злокачественных тканей, а также уничтожение переродившихся гемоцитобластов, наличие которых в составе крови будет вести к нарастанию симптомов опасного онкологического заболевания. Всеми перечисленными видами действия обладают препараты-цитостатики, доказавшие свою эффективность в борьбе с лейкозом на средних стадиях развития патологии. Метод химиотерапии до настоящего времени не имеет аналогов и находит самое широкое применение в онкогемалотологии. Однако специалисты знают, что введение в организм сильнодействующих химических составов может повлечь за собой целый набор побочных эффектов, имеющих определенную опасность для ослабленного организма пациента.
Основная проблема, которая может возникнуть после курса химиотерапии, — уничтожение здоровых клеток крови. Это может стать причиной опасного состояния пациента из-за следующих проблем:
- Снижение количества лейкоцитов может стать причиной инфицирования организма и развития опасных заболеваний вирусной или бактериальной породы.
- Наличие в крови тромбов может стать причиной их отрыва и закупорки сосудов, что вызывает тяжелые состояния вплоть до летального исхода.
- Риск внутреннего кровотечения из-за грубых нарушений в составе крови.
Все перечисленные факторы обязательно учитываются в ходе разработки будущего курса химиотерапии. Поэтому пациент направляется на детальное обследование организма с целью выявить факторы, способные усугубить развитие побочных эффектов и в разы усилить их негативное действие на ослабленный организм.
Применение химиотерапии для лечения лейкозов на различных стадиях
Выбор стратегии лечения во многом определяется стадией заболевания, уточнить симптомы которой позволяют лабораторные исследования крови пациента. Важным моментом является возможный факт отказа онколога от назначения химиотерапии в случае, если он не уверен в ее положительном действии на организм. Тем более что современная медицина не располагает данными статистики о конкретных результатах воздействия препаратов на организм на той или иной стадии патологии.
В зависимости от наблюдаемых признаков специалисты могут говорить о следующих стадиях развития онкологического заболевания:
- Начальная стадия, когда симптомы имеют слабовыраженный характер. На данном этапе химиотерапия не применяется из-за невозможности точно прогнозировать результат лечения. Тем более что остановить патологический процесс на нулевой или начальной стадии можно с помощью консервативного лечения, более щадящего для организма пациента.
- Развернутая стадия. На данном этапе химиотерапия необходима для восстановления утраченного здоровья, улучшения самочувствия, приостановки процессов увеличения выработки белых кровяных телец, перехода из острой стадии заболевания в стадию ремиссии. Кроме того, на данном этапе химиотерапия может справиться с онкопатологией, снизив вероятность ее рецидива в обозримом будущем.
- Терминальная стадия. На данном этапе химиотерапия носит больше поддерживающий характер паллиативной помощи, помогая справиться с болевыми ощущениями, грубыми нарушениями в работе внутренних органов, возможным риском их отказа и другими негативными признаками заболевания крови.
Распространенная тактика – назначение химиотерапии после наступления стадии бластного криза. Достаточно двух месяцев курса, чтобы получить длительную ремиссию и помочь организму пациента хотя бы частично восстановиться после победы над опасным недугом.
Важно помнить: использование в ходе химиотерапии сильнодействующих препаратов приводит к поражению как мутировавших, так и здоровых клеток крови. Результат проявляется в виде различных побочных эффектов, которые снимаются методом приема соответствующих медикаментов и при условии строгого соблюдения рекомендаций лечащего врача. В числе наиболее частых негативных результатов пройденного курса лечения химиотерапии стоит выделить:
- Замедление процесса выработки новых клеток крови – эритроцитов, лейкоцитов, тромбоцитов, уменьшение их количества и скорости развития, что влияет на состав крови и питание внутренних органов и тканей организма пациента. На фоне рака крови у него могут развиться лейкопения, анемия, тромбоцитопения.
- Негативное воздействие на волосяные луковицы, из-за чего у пациента редеют и выпадают волосы. Однако после завершения курса химиотерапии их рост постепенно восстанавливается.
- Неблагоприятное воздействие на структуру и химический состав слизистой оболочки пищеварительного тракта приводит к нарушениям в работе внутренних органов системы ЖКТ. У пациента могут отмечаться потеря аппетита, рвота, образование язвочек в полости рта, систематическая диарея и т.д.
Для пациентов мужского пола неприятным последствием химиотерапии может стать нарушение репродуктивной функции вплоть до бесплодия. Решением проблемы может стать сдача семенной жидкости для ее последующего консервирования и процедуры искусственного оплодотворения. У женщин могут отмечаться аменорея, появление признаков климактерических изменений, приливы, сбои менструального цикла и т.д. Часть побочных эффектов сходит на нет после завершения курса, но некоторые из них имеют необратимые последствия, о чем обязательно уведомляют пациента перед началом курса. Одновременно специалист поясняет, сколько курсов химиотерапии назначают при лейкозе, и каким методом будет происходить лечение.
ГДЕ МОЖНО ПРОЙТИ ПРОЦЕДУРУ:
Записаться на процедуру и узнать ее стоимость можно по телефону +7 (495) 266-95-40 или при личном визите в клинику: Москва, 2-й Тверской-Ямской переулок, д.10.
Источник: inuclear.ru
Острый лимфобластный лейкоз
Острый лимфобластный лейкоз – злокачественное поражение системы кроветворения, сопровождающееся неконтролируемым увеличением количества лимфобластов. Проявляется анемией, симптомами интоксикации, увеличением лимфоузлов, печени и селезенки, повышенной кровоточивостью и дыхательными расстройствами.
Из-за снижения иммунитета при остром лимфобластном лейкозе часто развиваются инфекционные заболевания. Возможно поражение ЦНС. Диагноз выставляется на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
C91.0 Острый лимфобластный лейкоз
- Причины острого лимфобластного лейкоза
- Симптомы острого лимфобластного лейкоза
- Диагностика острого лимфобластного лейкоза
- Лечение и прогноз при остром лимфобластном лейкозе
- Цены на лечение
Общие сведения
Острый лимфобластный лейкоз (ОЛЛ) – самое распространенное онкологическое заболевание детского возраста. Доля ОЛЛ составляет 75-80% от общего количества случаев болезней системы кроветворения у детей. Пик заболеваемости приходится на возраст 1-6 лет. Мальчики страдают чаще девочек. Взрослые пациенты болеют в 8-10 раз реже детей.
У пациентов детского возраста острый лимфобластный лейкоз возникает первично, у взрослых нередко является осложнением хронического лимфоцитарного лейкоза. По своим клиническим проявлениям ОЛЛ схож с другими острыми лейкозами. Отличительной особенностью является более частое поражение оболочек головного и спинного мозга (нейролейкоз), при отсутствии профилактики развивающееся у 30-50% пациентов. Лечение осуществляют специалисты в области онкологии и гематологии.
В соответствии с классификацией ВОЗ различают четыре типа ОЛЛ: пре-пре-В-клеточный, пре-В-клеточный, В-клеточный и Т-клеточный. В-клеточные острые лимфобластные лейкозы составляют 80-85% от общего количества случаев заболевания. Первый пик заболеваемости приходится на возраст 3 года. В последующем вероятность развития ОЛЛ повышается после 60 лет.
Т-клеточный лейкоз составляет 15-20% от общего количества случаев болезни. Пик заболеваемости приходится на возраст 15 лет.

Острый лимфобластный лейкоз
Причины острого лимфобластного лейкоза
Непосредственной причиной острого лимфобластного лейкоза является образование злокачественного клона – группы клеток, обладающих способностью к неконтролируемому размножению. Клон образуется в результате хромосомных аберраций: транслокации (обмена участками между двумя хромосомами), делеции (утраты участка хромосомы), инверсии (переворота участка хромосомы) или амплификации (образования дополнительных копий участка хромосомы). Предполагается, что генетические нарушения, вызывающие развитие острого лимфобластного лейкоза, возникают еще во внутриутробном периоде, однако для завершения процесса формирования злокачественного клона нередко требуются дополнительные внешние обстоятельства.
В числе факторов риска возникновения острого лимфобластного лейкоза обычно в первую очередь указывают лучевые воздействия: проживание в зоне с повышенным уровнем ионизирующей радиации, радиотерапию при лечении других онкологических заболеваний, многочисленные рентгенологические исследования, в том числе во внутриутробном периоде. Уровень связи, а также доказанность наличия зависимости между различными лучевыми воздействиями и развитием острого лимфобластного лейкоза сильно различаются.
Так, взаимосвязь между лейкозами и лучевой терапией в наши дни считается доказанной. Риск возникновения острого лимфобластного лейкоза после радиотерапии составляет 10%. У 85% пациентов болезнь диагностируется в течение 10 лет после окончания курса лучевой терапии. Связь между рентгенологическими исследованиями и развитием острого лимфобластного лейкоза в настоящее время остается на уровне предположений. Достоверных статистических данных, подтверждающих эту теорию, пока не существует.
Многие исследователи указывают на возможную связь между ОЛЛ и инфекционными заболеваниями. Вирус возбудителя острого лимфобластного лейкоза пока не выявлен. Существуют две основные гипотезы. Первая – ОЛЛ вызывается одним пока не установленным вирусом, однако болезнь возникает только при наличии предрасположенности.
Вторая – причиной развития острого лимфобластного лейкоза могут стать разные вирусы, риск развития лейкоза у детей повышается при недостатке контактов с патогенными микроорганизмами в раннем возрасте (при «нетренированности» иммунной системы). Пока обе гипотезы не доказаны. Достоверные сведения о наличии связи между лейкозами и вирусными заболеваниями получены только для Т-клеточных лейкозов у взрослых больных, проживающих в странах Азии.
Вероятность развития острого лимфобластного лейкоза повышается при контакте матери с некоторыми токсическими веществами в период гестации, при некоторых генетических аномалиях (анемии Фанкони, синдроме Дауна, синдроме Швахмана, синдроме Клайнфельтера, синдроме Вискотта-Олдрича, нейрофиброматозе, целиакии, наследственно обусловленных иммунных нарушениях), наличии онкологических заболеваний в семейном анамнезе и приеме цитостатиков. Некоторые специалисты отмечают возможное негативное влияние курения.
Симптомы острого лимфобластного лейкоза
Болезнь развивается стремительно. К моменту постановки диагноза суммарная масса лимфобластов в организме может составлять 3-4% от общей массы тела, что обусловлено бурной пролиферацией клеток злокачественного клона на протяжении 1-3 предыдущих месяцев. В течение недели количество клеток увеличивается примерно вдвое. Различают несколько синдромов, характерных для острого лимфобластного лейкоза: интоксикационный, гиперпластический, анемический, геморрагический, инфекционный.
Интоксикационный синдром включает в себя слабость, утомляемость, лихорадку и потерю веса. Повышение температуры может провоцироваться как основным заболеванием, так и инфекционными осложнениями, которые особенно часто развиваются при наличии нейтропении. Гиперпластический синдром при остром лимфобластном лейкозе проявляется увеличением лимфоузлов, печени и селезенки (в результате лейкемической инфильтрации паренхимы органов). При увеличении паренхиматозных органов могут появляться боли в животе. Увеличение объема костного мозга, инфильтрация надкостницы и тканей суставных капсул могут становиться причиной ломящих костно-суставных болей.
О наличии анемического синдрома свидетельствуют слабость, головокружения, бледность кожи и учащение сердечных сокращений. Причиной развития геморрагического синдрома при остром лимфобластном лейкозе становятся тромбоцитопения и тромбозы мелких сосудов. На коже и слизистых выявляются петехии и экхимозы. При ушибах легко возникают обширные подкожные кровоизлияния.
Наблюдаются повышенная кровоточивость из ран и царапин, кровоизлияния в сетчатку, десневые и носовые кровотечения. У некоторых больных острым лимфобластным лейкозом возникают желудочно-кишечные кровотечения, сопровождающиеся кровавой рвотой и дегтеобразным стулом.
Иммунные нарушения при остром лимфобластном лейкозе проявляются частым инфицированием ран, царапин и следов от уколов. Могут развиваться различные бактериальные, вирусные и грибковые инфекции. При увеличении лимфатических узлов средостения отмечаются нарушения дыхания, обусловленные уменьшением объема легких. Дыхательная недостаточность чаще обнаруживается при Т-клеточном остром лимфобластном лейкозе. Нейролейкозы, спровоцированные инфильтрацией оболочек спинного и головного мозга, чаще отмечаются во время рецидивов.
При вовлечении ЦНС выявляются положительные менингеальные симптомы и признаки повышения внутричерепного давления (отек дисков зрительных нервов, головная боль, тошнота и рвота). Иногда поражение ЦНС при остром лимфобластном лейкозе протекает бессимптомно и диагностируется только после исследования цереброспинальной жидкости. У 5-30% мальчиков появляются инфильтраты в яичках.
У пациентов обоих полов на коже и слизистых оболочках могут возникать багрово-синюшные инфильтраты (лейкемиды). В редких случаях наблюдаются выпотной перикардит и нарушения функции почек. Описаны случаи поражений кишечника.
С учетом особенностей клинической симптоматики можно выделить четыре периода развития острого лимфобластного лейкоза: начальный, разгара, ремиссии, терминальный. Продолжительность начального периода составляет 1-3 месяца. Преобладает неспецифическая симптоматика: вялость, утомляемость, ухудшение аппетита, субфебрилитет и нарастающая бледность кожи.
Возможны головные боли, боли в животе, костях и суставах. В период разгара острого лимфобластного лейкоза выявляются все перечисленные выше характерные синдромы. В период ремиссии проявления болезни исчезают. Терминальный период характеризуется прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика острого лимфобластного лейкоза
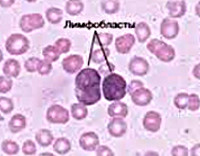
Диагноз выставляют с учетом клинических признаков, результатов анализа периферической крови и данных миелограммы. В периферической крови пациентов с острым лимфобластным лейкозом выявляются анемия, тромбоцитопения, повышение СОЭ и изменение количества лейкоцитов (обычно – лейкоцитоз). Лимфобласты составляют 15-20 и более процентов от общего количества лейкоцитов. Количество нейтрофилов снижено. В миелограмме преобладают бластные клетки, определяется выраженное угнетение эритроидного, нейтрофильного и тромбоцитарного ростка.
В программу обследования при остром лимфобластном лейкозе входят люмбальная пункция (для исключения нейролейкоза), УЗИ органов брюшной полости (для оценки состояния паренхиматозных органов и лимфатических узлов), рентгенография грудной клетки (для обнаружения увеличенных лимфоузлов средостения) и биохимический анализ крови (для выявления нарушений функции печени и почек). Дифференциальный диагноз острого лимфобластного лейкоза проводят с другими лейкозами, отравлениями, состояниями при тяжелых инфекционных заболеваниях, инфекционным лимфоцитозом и инфекционным мононуклеозом.
Лечение и прогноз при остром лимфобластном лейкозе
Основой терапии являются химиопрепараты. Выделяют два этапа лечения ОЛЛ: этап интенсивной терапии и этап поддерживающей терапии. Этап интенсивной терапии острого лимфобластного лейкоза включает в себя две фазы и длится около полугода. В первой фазе осуществляют внутривенную полихимиотерапию для достижения ремиссии.
О состоянии ремиссии свидетельствуют нормализация кроветворения, наличие не более 5% бластов в костном мозге и отсутствие бластов в периферической крови. Во второй фазе проводят мероприятия для продления ремиссии, замедления или прекращения пролиферации клеток злокачественного клона. Введение препаратов также осуществляют внутривенно.
Продолжительность этапа поддерживающей терапии при остром лимфобластном лейкозе составляет около 2 лет. В этот период больного выписывают на амбулаторное лечение, назначают препараты для перорального приема, осуществляют регулярные обследования для контроля над состоянием костного мозга и периферической крови.
План лечения острого лимфобластного лейкоза составляют индивидуально с учетом уровня риска у конкретного больного. Наряду с химиотерапией используют иммунохимиотерапию, радиотерапию и другие методики. При низкой эффективности лечения и высоком риске развития рецидивов осуществляют трансплантацию костного мозга. Средняя пятилетняя выживаемость при В-клеточном остром лимфобластном лейкозе в детском возрасте составляет 80-85%, во взрослом – 35-40%. При Т-лимфобластном лейкозе прогноз менее благоприятен.
Источник: www.krasotaimedicina.ru