Что такое GMP и почему о нём все говорят?
GMP в переводе на русский означает «надлежащая производственная практика» . Определение из Википедии гласит, что это правила, которые устанавливают требования к организации производства и контроля качества лекарственных средств для медицинского и ветеринарного применения. Но понятнее от этого не становится абсолютно.
Что такое GMP? Прежде всего это такой документ, в котором собраны рекомендации к тому, как должно быть устроено предприятие, чтобы оно выпускало качественный продукт. Многие даже отмечают, что это именно философия. Но соблюдение условий этой философии во много странах обязательно по закону. (В России к этому обязывает приказ Минпромторга №916)
Зачем это нужно? Опять же для качества выпускаемой продукции. Объясню на примере производства сапог. Какое-то большое предприятие их выпускает, получает прибыль и все хорошо, а потом что-то идёт не так и партия оказывается бракованной: у всех сапог отклеилась подошва через некоторое время.
Что такое стандарт GMP
И владелец предприятия начинает выяснять, что пошло не так и как не допустить этого в дальнейшем. Может быть, мы закупили плохой материал для подошвы, а может быть это новый сотрудник ввиду недостаточного опыта напортачил, а может у нас оборудование вышло из строя. И при подходе, когда мы просто выпускаем продукт и больше его никак не контролируем, этого не достаточно. Необходимы дополнительные мероприятия, направленные на улучшение качества продукции. И именно об этом GMP.
Конечно, фармацевтическое предприятие устроено сложнее. Даже то, в котором система GMP не развита. Сотрудники соблюдают чистоту, ходят в халатах, контролируют продукцию перед тем, как она попадает в аптеки. Но и этого тоже, увы, недостаточно. Например, вы уже изготовили продукт, но не соблюли условия его транспортировки. А это тоже важно.
Нюансов при таком сложно производстве, от которого зависят жизни и здоровье людей много и чтобы это все учесть, нужно соблюдать правила GMP.
Можно выделить два основных правила GMP:
1. «То, что не записано, то не сделано». Из-за большого количества бумаг, многие шутливо расшифровывают GMP как give many papers. На первый взгляд действительно может показаться, что бюрократической работы очень много. Но такой подход позволяет сделать систему на производстве как можно более прозрачной.
Ты всегда можешь поднять ту или иную запись и посмотреть результаты анализа/реактивы, которые были использованы/классификацию оборудования/сотрудника, который анализ провёл. В общем, прослеживаемость максимальная. Так можно с большей вероятностью найти причину брака. Согласитесь, это проще сделать в такой системе, чем в той, в которой царит хаос.
2. Работа исключительно по СОПам . СОП — это стандартная операционная процедура. И это большая боль для тех, кто любит работать по принципу «я художник — я так вижу» . СОП — это четкий и простой алгоритм действий сотрудника производства и затрагивает он не только хода выполнения анализа, но вообще всю жизнь предприятия в целом.
ЧТО ТАКОЕ СТАНДАРТ GMP
Начиная от правил переодевания, заканчивая валидацией процессов (тоже страшное слово, да?). И если в СОПе написано, что нужно взвесить 100 г навески, то мы взвешиваем именно такое количество и никак иначе. Зачем это нужно? Если мы хотим, чтоб предприятие выпускало стабильно качественный продукт, то нужно свести действия всех сотрудников к единому стандарту. Ведь если в оркестре каждый музыкант начнёт играть по каким-то своим нотам, то никакого выступления не получится, даже если у оркестра талантливый дирижер?
Почему это важно для нас, потребителей? GMP — это гарант того, что продукт сделан хорошо и качественно. Он безопасен для потребителя и не нанесёт вашему здоровью вред. Поэтому многие в рекламе препаратов вставляют надпись «выполнено по стандартам GMP”. И если это так, то производители действительно могут собой гордиться.
Ибо реализация этих стандартов — это сложно и дорого. Чтобы получит сертификат соответствия GMP, нужно пройти множество серьезных проверок, нужно затратить немалое количество денег на качественное сырье и оборудование, также нужно тщательно продумать все помещения и иметь квалифицированных сотрудников.
В России GMP ещё под вопросам, далеко не все предприятия работают по этим стандартам, мы только на пути к этому.
Источник: dzen.ru
Программа gmp что это

Посетители аптек становятся все более требовательными и все чаще задают вопросы о качестве лекарственных средств. При этом более доступные по цене российские ЛС нередко вызывают у них недоверие. Как развеять сомнения? Для аргументированного разговора с покупателем первостольнику нужно иметь представление о современных требованиях надлежащей производственной практики лекарственных препаратов (GMP).
Пренебрежительное отношение к ЛС отечественного производства – устойчивый стереотип, прочно укоренившийся в сознании российского обывателя. Между тем в течение последнего десятилетия государство предпринимает очень активные усилия по развитию фармацевтической промышленности РФ. И главный акцент делается в первую очередь на повышение качества российской фармпродукции. В настоящее время ведущие российские компании привели свои производства в соответствие международным стандартам. Наличие сертификата GMP свидетельствует о том, что на предприятии делается все необходимое для контроля качества и безопасности выпускаемых лекарств.
Главная задача стандартов GMP – обеспечение безопасности конечного потребителя ЛС
Что такое GMP?
Надлежащая производственная практика, или GMP (Good Manufacturing Practice), – это система правил, обеспечивающих непрерывный контроль качества на всех этапах производства фармацевтической продукции. До внедрения GMP проверке и тестированию на фармпредприятиях мог подвергаться только конечный продукт, это оставляло слишком много пробелов в контроле над многоступенчатым процессом изготовления ЛС. Стандарты надлежащей производственной практики формулируются государственными органами, регулирующими фармацевтический рынок.
Как все начиналось
«Талидомидовая катастрофа» – массовое применение недостаточно изученного препарата для беременных женщин, ставшее причиной рождения тысяч детей с тяжелейшими аномалиями развития конечностей в конце 50-х – начале 60-х годов XX века, – оказала решающее влияние не только на формирование практики доклинических и клинических исследований ЛС, но и на ужесточение требований к фармпромышленности. В 1962 году в США были приняты поправки в законодательство о лекарствах, вводившее жесткие требования к организации их производства. По сути, этот документ стал первым сводом правил надлежащей производственной практики. Аналогичные стандарты вскоре были разработаны в других развитых странах. В 1967 году ВОЗ приступила к созданию собственных правил GMP, в 1969 году они были рекомендованы к внедрению странам – членам организации.
По состоянию на начало октября в реестре Минпромторга значатся 415 действующих сертификатов GMP, выданных более чем 150 фармпроизводителям, работающим на территории РФ

GMP пришел в Россию
Советская, а вслед за ней и российская система контроля качества фармацевтической продукции на протяжении нескольких десятилетий не была гармонизирована с международными требованиями. Несколько попыток внедрения GMP в России в конце 90-х – начале 2000-х годов потерпели неудачу из-за неготовности многих отечественных предприятий к радикальным преобразованиям.
Ситуация кардинально изменилась после запуска государственной программы модернизации фармацевтической промышленности. В 2013 году приказом Министерства промышленности и торговли были утверждены российские правила GMP, носящие обязательный характер для фармпроизводителей. Этот документ с небольшими изменениями воспроизводил актуальный стандарт GMP, действующий в Европейском союзе. Фармпроизводителям предоставлен переходный период для приведения своих площадок в соответствие с новыми требованиями.
Рассмотрим некоторые разделы правил GMP, чтобы понять, что изменилось на производстве после их внедрения.
Независимая оценка качества
Производство лекарственных препаратов зависит от человеческого фактора. Важное условие высокого качества фармпродукции – полная независимость руководителей производственного подразделения и отдела контроля качества друг от друга.
Такой подход гарантирует, что отбор проб, испытания, документирование всех этапов контроля были организованы в соответствии с рекомендованной методикой и проводились без отклонений от установленных процедур.
Уполномоченное лицо, представляющее производителя, должно подтвердить, что каждая серия лекарственных средств произведена и испытана в соответствии с требованиями регистрационного досье.

Непрерывное обучение
Производитель должен допускать на фармацевтическое предприятие только специальным образом подготовленный персонал. Важно обеспечить постоянное обучение сотрудников, которые находятся в производственных зонах или контрольных лабораториях. Обучению подлежит не только технический и обслуживающий персонал, но и работники, проводящие уборку. Производитель отвечает как за проведение непрерывного обучения, так и за оценку его эффективности.
Требования к персоналу
На производителя возложена обязанность по проведению комплекса мероприятий по производственной гигиене. Существуют детализированные требования к состоянию здоровья, санитарным правилам и одежде (стерильные костюмы, шапочки, маски, сменная обувь и т.д.) сотрудников фармацевтического предприятия. Каждый работник, находящийся в зонах производства и зонах контроля качества, должен строго соблюдать их.
Планировка помещений минимизирует риски
Ошибки случаются при любом виде деятельности. Чтобы свести к минимуму их вероятность, производственные помещения должны быть расположены и оснащены определенным образом. Оборудование в цехах размещается так, чтобы обеспечивать возможность эффективной очистки помещений.
Также необходимо определить и строго соблюдать параметры влажности, температуры, микробиологической и химической чистоты. Такой подход помогает исключить влияние любых неблагоприятных факторов на качество продукции. Планировка помещений и оборудование должны обеспечить исключение перекрестной контаминации остатками сырья или продукции, накопления пыли или грязи.
Стандартизация и отчетность
Технологические операции осуществляются по четко установленным процедурам квалифицированным персоналом. Все предписания направлены на получение продукции требуемого качества, в соответствии с лицензией на производство лекарственных средств и регистрационным досье.
В частности, детально прописаны процедуры для исходного сырья, упаковочного материала, их приемки, карантина, хранения, маркировки, выдачи в производство. К закупке сырья предъявляются строгие требования. Оно должно закупаться только у утвержденных поставщиков, указанных в спецификации. При этом спецификации производителя четко согласуются с поставщиками.

Упаковка контролируется так же жестко, как и сырье
Внимание уделяется как первичной упаковке, так и печатным материалам. Они должны храниться в местах, исключающих доступ посторонних лиц. Разрезанные или разрозненные этикетки и упаковки складируются раздельно, так, чтобы исключить перепутывание. За выдачу упаковочного материала отвечает специально обученный персонал.
Просроченные или непригодные к использованию материалы должны быть уничтожены, процесс уничтожения оформляется документально. Перед началом упаковки рабочая зона и упаковочные линии должны быть очищены от любого ранее использованного лекарственного сырья. Особые меры предосторожности должны соблюдаться при работе с разрезанными этикетками и нанесении маркировки вне линии упаковки.
«Теория, мой друг, суха, но зеленеет жизни древо», – сказал Гете. Что нам с того, что мы знаем стандарты надлежащей производственной практики? Нужно уметь донести до наших клиентов эту информацию простым и понятным языком.
Разговор с покупателем

- Не стоит активно заводить речь о качестве лекарства, если клиент об этом не спрашивает. А вот если он сам выразил заинтересованность, пояснения дать необходимо.
- Наиболее вероятный вопрос: «Этот препарат значительно дешевле импортного, но какие гарантии, что он будет работать так же, как зарубежный аналог?».
- Покажите клиенту свое понимание его точки зрения, а потом дайте развернутый комментарий: «Вы правы, здоровье у нас одно, и лекарства хочется принимать качественные. Этот препарат изготовлен на заводе, который работает по международным стандартам. Это означает строгий контроль качества исходного сырья, особую планировку помещений, исключающую риск появления вредных примесей, высокую квалификацию персонала. Ну и самое главное: контролируются абсолютно все этапы производства. Наличие сертификата GMP говорит о том, что риск любого брака на производстве минимален».
- Сокращенный вариант сообщения может быть таким: «Этот препарат изготовлен по правилам, которые установлены международным сообществом для обеспечения высокого качества и безопасности ЛС».
- Помните, что клиент ждет от вас аргументированного и понятного разъяснения. В большинстве случаев грамотной рекомендации специалиста достаточно для того, чтобы развеять любые сомнения покупателя.
Источник: rosapteki.ru
Программа gmp что это
1. Витол, И.С., Коваленок, А.В., и др. Безопасность продовольственного сырья и продуктов питания / И.С. Витол, А.В. Коваленок, А.П. Нечаев. – М.: ДеЛи принт, 2013. – 352 с.
2. Гаврилова, Ю.А. О проблемах обеспечения безопасности продукции агропромышленного комплекса / Ю.А. Гаврилова // Успехи современного естествознания, №5, 2014 – С. 223-224.
3. Шилов, Г.Ю., Лейнсон, И.Н. и др. Основные системы обеспечения качества и безопасности пищевой продукции / Г.Ю. Шилов, И.Н. Лейнсон, И.А. Подлесный // Пищевая промышленность, №11, 2008. – С.12-14.
Производство качественной и безопасной продукции – одна из основных составляющих народного хозяйства страны. Продовольственные волнения, связанные с поступлением на отечественные рынки некачественной продукции, расширение глобальных систем поставок и нехватка надлежащих механизмов контроля стали основными факторами для внедрения высокоэффективных систем обеспечения качества на предприятиях пищевой промышленности [2].
В настоящее время в российской производственной практике используются следующие основные системы обеспечения качества и безопасности пищевой продукции:
GMP (Good Manufacture Practice) – хорошая производственная практика;
GHP (Good Hygiene Practice) – хорошая гигиеническая практика;
НАССР (Hazard Analysis Critical Control Points) – анализ рисков и критические контрольные точки;
Системы управления качеством по стандартам ISO: серия ISO 9000 включает ISO 9000, ISO 9001 и ISO 9004 – системы управления качеством; ISO 14000 – управление окружающей средой; ISO 18000 – управление безопасностью и гигиеной труда; ISO 17000 – аккредитацию лабораторий;
Система менеджмента безопасности в соответствии с требованиями международного стандарта ISO 22 000 «Food safety management systems – requirements for any organization in food chain»;
ППК (программа производственного контроля) – разрабатывается юридическими лицами и индивидуальными предпринимателями на всех предприятиях в РФ в соответствии с СП 1.1.1058 – 01 «Организация и проведение производственного контроля за соблюдением санитарных правил и выполнением санитарно-противоэпидемических (профилактических) мероприятий» [3].
Стандарт GMP – это система мер и правил обеспечения качества производства, состоящая из нескольких направлений, которые включают в себя достаточно обширный ряд норм, указаний в отношении фармацевтической и микроэлектронной промышленности, высокотехнологичных отраслей промышленного производства (производства продуктов питания, оптической и упаковочной промышленности, медицинской и сенсорной технике, а также в микромеханической промышленности).
Отличительная особенность данного стандарта заключается в том, что он предполагает комплексную лабораторную проверку и регулирование всех параметров производства, в то время как обычная процедура контроля качества предполагает исследование лишь отдельных образцов продукции и гарантирует только их качество, или же качество целой партии и/или еще нескольких партий продукции, выпущенных в тот же период времени.
Суть GMP заключается в абсолютной исполнительской дисциплине на основе всеобщего документирования и доказательства правильности функционирования оборудования и технологических процессов.
Принципы GMP успешно используются в фармацевтической промышленности и предназначены для снижения риска, присущего фармацевтической продукции, который не может быть полностью предотвращен путем проведения испытания готовой продукции.
Внедрению системы GMP на предприятиях пищевой промышленности способствовало развитие сегмента производства детского и специализированного питания, пищевых и биологически активных добавок, увеличение объемов производства и ужесточение требований к качеству и безопасности производимой продукции.
Система GMP формирует ряд конкретных требований у организации производства, выполнение которых необходимо для обеспечения качества продукции и предполагает наличие системы управления предприятием. Таким образом, система обеспечения качества и безопасности пищевой продукции, базирующаяся на совмещении стандартов ISO 9001:2008 и GMP, может служить эффективным инструментом, позволяющим обеспечить процессный подход к управлению производством и обеспечению выпуска безопасной продукции [1].
Основополагающие правила GMP: 1) описание всех технологических процессов на производстве и контроль за ними; 2) валидация каждого этапа производственного процесса; 3) обеспечение производства соответствующими помещениями, оборудованием, обученным персоналом; 4) контроль качества сырья, упаковки, вспомогательных материалов, их правильного хранения и транспортировки; 5) регулярное обучение персонала по технологической программе с дальнейшим ассесментом; б) личная гигиена персонала; 7) обеспечение контроля за стеклом и пластиком, используемым на производстве; 8) планировка помещений и план расстановки оборудования; 9) контроль за состоянием оборудования; 10) контроль качества и безопасности воды и воздуха; 11) контроль потоков сырья, полуфабрикатов и готовой продукции с целью исключения перекрестного загрязнения.
Систему GMP целесообразно рассматривать в совокупности с другими программами предварительных мероприятий, важными для обеспечения безопасности пищевых продуктов: практика прослеживаемости производимой продукции, санитарно-гигиеническая практика (GHP), программа борьбы с вредителями, контроль за химическими препаратами, используемыми на производстве, программа работы с рекламациями потребителей, программа контроля и оценки поставщиков, программа поверки и калибровки оборудования, программа внутренних и внешних аудитов [3].
Как показывает опыт предприятий, внедривших и реализующих свою деятельность в соответствии с принципами GMP, наряду с ростом качества и безопасности вырабатываемой продукции происходит снижение затрат на контроль качества и, соответственно, издержек на утилизацию несоответствующей продукции. Отдельно следует отметить роль системы GMP в формировании позитивного имиджа производителя, что играет немаловажную роль в условиях жесткой конкурентной борьбы в пищевой индустрии.
Источник: natural-sciences.ru
Сертификат GMP: подтверждение качества лекарственных средств

Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
- К каким производствам применима эта процедура?
- Стандарт GMP в международной практике
- Правила GMP в России
- Процедура получения сертификата в России
- Стоимость получения сертификата
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
- лекарственные препараты;
- медицинские изделия различного назначения, включая те из них, которые применяются в диагностических целях;
- продукты питания и ингредиенты для их производства;
- биологически активные добавки.
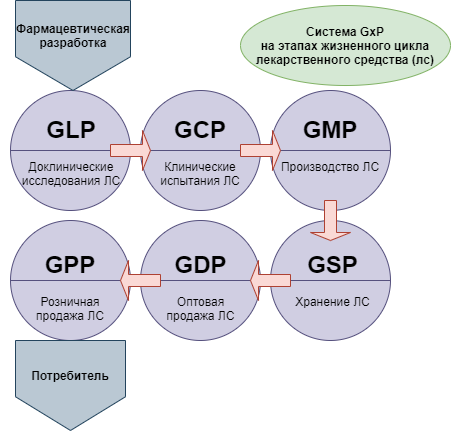
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
- GLP — Good Laboratory Practice (надлежащая лабораторная практика);
- GCP — Good Clinical Practice (надлежащая клиническая практика);
- GDP — Good Distributon Practice (надлежащая дистрибьюторская практика);
- GACP — Good Agricultural and Collection Practice (надлежащая практика культивирования и сбора лекарственных растений).
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
- национальный стандарт РФ ГОСТ Р 52249-2009, устанавливающий правила изготовления и контроля качества лекарственных препаратов;
- постановление Правительства от 5 июня 2008 года N 438 с рядом изменений, внесенных за последние годы, которое утверждает полномочия Министерства промышленности и торговли в этой области;
- постановление Правительства от 3 декабря 2015 года N 1314, устанавливающее порядок оценки соответствия производителей требованиям стандарта надлежащей практики;
- приказ Минпромторга от 14 июня 2013 года N 916, утверждающий правила применения надлежащей производственной практики в соответствии с актуальным стандартом;
- приказ Минпромторга от 26 мая 2016 года N 1714, определяющий административный регламент предоставления государственной услуги по выдаче документации, подтверждающей соответствие изготовителя установленным нормам надлежащей производственной практики;
- приказ Минпромторга России от 17.12.2015 N 4119, утверждающий правила ведения реестра сведений о том, какие лекарства имеют сертификат качества GMP в России.
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
- Решение Совета ЕЭК от 3 ноября 2016 года N 77, утверждающее правила надлежащей производственной практики в границах ЕАЭС;
- Приказ Минпромторга от 4 сентября 2020 года N 2945, которым введен административный регламент предоставления госуслуги по выдаче документации, подтверждающей соответствие производств установленным правилам.
Обратите внимание!
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
- стабильное качество продукции, не зависящее от внешних факторов;
- повышение доверия потребителей, включая крупных оптовых покупателей, которые всегда отслеживают, какие производители имеют сертификат соответствия GMP на их продукцию;
- возможность вывода продукции на международные рынки, где ее может купить гораздо больше потребителей;
- возможность привлечения инвесторов для реализации проектов по расширению производства;
- получение преимуществ при участии в конкурсном отборе поставщиков, в том числе для государственных закупок.
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
- оценка производства на соответствие критериям безопасности, включая проведение его проверки в отношении вероятности попадания в продукт посторонних примесей и веществ;
- оценка производства на соблюдение технических требований к выпуску продукции, включая выполнение условий относительно влажности, температуры и других параметров в производственных помещениях;
- оценка качества, безопасности и действенности лекарственных средств, производимых на конкретном предприятии;
- оценка соответствия параметров производства и характеристик лекарственного средства нормативной документации, принятой в рамках процедуры GMP.
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
- копию документа, подтверждающего наличие у заявителя полномочий по взаимодействию с контролирующей организацией;
- копия основного досье используемого производственного объекта;
- информация о фактах несоответствия препарата действующим требованиям к качеству и безопасности и о фактах отзыва медикамента из оборота за период не менее 2 лет;
- полный список лекарств, который изготавливаются на данном производственном объекте;
- копия лицензии на производство лекарств;
- письмо о согласии на проведение инспекции производства.
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
Этап сертификационной процедуры
Максимальная допустимая продолжительность
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции
10 рабочих дней
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку
Инспектирование и анализ лекарственного средства
160 рабочих дней
Принятие решения о выдаче заключения по результатам инспекционного отчета
10 рабочих дней
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
Источник: www.centrattek.ru
GMP – надлежащая производственная практика
Международный стандарт GMP (Good Manufacturing Practice, Надлежащая производственная практика) – система норм, свод правил и указаний, способствующих обеспечению качественного производственного процесса, в том числе хранения и испытаний продукции.

Этот стандарт включает множество показателей, которым должны соответствовать предприятия, выпускающие ту или иную продукцию. Его главное отличие от процедуры контроля качества, где исследуются выборочные образцы продуктов и обеспечивается пригодность лишь этих самих образцов (возможно, их партий), GMP отражает целостный подход и регулирует, оценивает собственно параметры производства и лабораторной проверки.
GMP нашел широкое применение в фармацевтической промышленности, при производстве микроэлектронных устройств, в высокотехнологичных отраслях промышленного изготовления продуктов питания, упаковочной, оптической продукции, сенсорных устройств, медицинской техники и пр.
Так, в комплексе со стандартами GLP (Good Laboratory Practice) – надлежащая лабораторная практика и GCP (Good Clinical Practice) – надлежащая клиническая практика GMP стандартизирует некоторые аспекты качества медицинского обслуживания населения.
Помимо этого в мировой практике распространены и другие стандарты надлежащих практик исследования, производства, дистрибуции, хранения и лекарственного обеспечения: GEP (Good Engeneering Practice) – надлежащая инженерная практика; GSP (Good storage practices for pharmaceuticals) – надлежащая практика хранения фармацевтической продукции; GPP (Good Pharmacy Practice) – надлежащая аптечная практика; GDP (Good Distribution Practice) – надлежащая дистрибуторская практика.
«Американская комната страха»
Начало настоящей борьбы за качество пищевых продуктов и лекарственных средств (ЛС) положили США в самом начале прошлого века – в 1906 году их конгресс принял Закон о доброкачественности пищевых продуктов и медицинских препаратов. Этот закон поспособствовал созданию одного из первых государственных контрольных органов в этой области, известного сейчас как FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) и также разрешал конфискацию нелегальных (фальсифицированных) пищевых продуктов и ЛС.
В 1933 году FDA организовало выставку, названную «Американской комнатой страха» и представляющую продукты, косметику, медицинские устройства и лекарственные препараты, смертельно опасные для человека. Среди экспонатов было устройство для поддержания матки (контрацептив) и прокалывающее ее при неправильном введении; препарат для похудания, неизбежно приводящий к смерти пациента; средство для удаления волос, вызывающее облысение; косметические средства на основе ртути, свинца; оральный «Эликсир сульфаниламида» на диэтиленгликоле, погубивший к тому времени 107 человек. Выставка, потрясшая многих американцев, привела к принятию нового более жесткого Закона о пищевых продуктах, медикаментах и косметике (1938), требующего от производителя подтверждения безопасности их продукции до ее появления в продаже и расширившего полномочия FDA (до остановки производства и уголовного преследования).
Далее – трагедия 1941 года. Около 300 человек, погибших и пострадавших от приема сульфатиазоловых таблеток (в их состав входил фенобарбитал), подтолкнули FDA к пересмотру требований к производству и контролю над качеством ЛС, а конгресс – к новому Закону «О здравоохранении», значительно приблизивших мир к системе GMP.
А следующий шаг к системе стандартов качества был связан с еще более драматическими событиями. Имя им – талидомид. Этот препарат на фармрынке Европы был представлен как средство от бессонницы и для избавления от утренней тошноты беременных. При его регистрации регулирующие учреждения и не предполагали насколько мощным тератогенным эффектом обладает это лекарство.
Число врожденных уродств у детей, рожденных матерями, принимавших препарат, насчитывало 10 тысяч. С этого времени новые строгие поправки в законодательство сделали обязательным подтверждение эффективности и безопасности ЛС в клинических исследованиях (до апробирования на людях – испытания на животных).
Без сомнения, человечество по-настоящему выстрадало свой путь к правилам GMP. Конечно же, фармацевтические скандалы продолжали будоражить общественное мнение. Были смерти от приема тайленола (отравленные капсулы ацетаминофена) и отзыв с рынка 31 млн упаковок этого популярного безрецептурного препарата. Был скандал с дженериковыми препаратами и недобросовестными сотрудниками FDA, получавших взятки. Но каждый из них вел к совершенствованию законодательства и стандартов GMP (1965, 1971, 1978, 1987, 1992 гг.).
И проблемы качества ЛС касались далеко не только США. Фармацевтический рынок во второй половине XX века развивался стремительно, приобретая глобальный характер и все сильнее ощущая потребность в формировании международных стандартов, позволяющих унифицировать, регламентировать производство, хранение и распространение ЛС. Активными инициаторами появления и продвижения правил GMP стали ответственные производители, не желавшие мириться с многочисленными конкурентами, не желавшие вкладывать значительные средства в систему обеспечения качества лекарств; новые компании, стремящиеся к цивилизованному рынку и эффективным вложениям капитала; страховые компании, умеющие профессионально считать деньги.
И вот история GMP, начавшаяся в США в 1963 году появлением на свет первых правил безопасного и качественного изготовления ЛС (стандартная форма официального документа принята в 1968 г.), получила поддержку международных экспертов. В 1968 году появился первый международный документ по GMP, разработанный специалистами Всемирной организации здравоохранения.
А через год была принята резолюция ВОЗ, рекомендующая применять правила GMP всем странам (1969). Восемь государств именно так и поступили. Сегодня национальные правила GMP имеются более чем в 40 странах. Помимо этого есть региональные правила GMP, правила GMP стран Евросоюза, стран-участников «соглашения по фармакологическому контролю», стран– членов ассоциации, стран юго-восточной Азии, международные правила GMP. По данным ВОЗ, в настоящее время свыше 140 стран участвуют в системе удостоверения качества медикаментов в международной торговле, основанной на соблюдении правил GMP.
Но тогда, в 1969 году, наша страна не поддержала инициативу ВОЗ. Минздрав СССР заявил о своей незаинтересованности во внедрении GMP – готовился собственный документ, предполагавший стандартизацию оборота ЛС по международным правилам. В 1974 году он появился (рекомендательные правила производства лекарств РТМ 64-7-81-74, пересмотренные в 1981 г. – правила ОМУ 64-33-81), надолго отложив вопрос перехода к GMP.
В 1991 году Европейский союз Директивой 356/91 утвердил новые правила GMP (GMP EU), для стран, входящих в него (в 2003 г. внесены изменения). В том же году Советский Союз попытался гармонизировать свое законодательство с международной практикой. Но только после его распада страны СНГ самостоятельно приступили к созданию нормативной базы по примеру международных.
Российский стандарт GMP начал готовиться с 1998 года (по аналогии с GMP EU). Правительством РФ была утверждена федеральная целевая программа «Развитие медицинской промышленности на 1998-2000 гг. и на период до 2005 г.», предусматривающая поэтапное внедрение требований GMP на российских фармацевтических предприятиях до 2006 г. В 2004 году появился ГОСТ
52.249-2004 «Правила производства и контроля качества ЛС».
Отечественные принципы GMP для фармацевтической отрасли регламентированы национальным стандартом ГОСТ Р 52249-2009 «Правила производства и контроля качества лекарственных средств» (утвержден и введен в действие приказом Федерального агентства по техническому регулированию и метрологии от 20 мая 2009 г. № 159-ст). Стандарт распространяется на все категории ЛС и прописывает общие требования к их изготовлению и контролю качества, а также конкретные требования к производству активных фармацевтических субстанций и отдельных видов лекарственных препаратов. Надо заметить, что GMP – это не добровольный, а обязательный набор правил, поэтому он подлежит проверке государством. В нашей стране инспектирование производителей ЛС на соответствие стандарту GMP проводит Федеральное бюджетное учреждение «Государственный институт лекарственных средств и надлежащих практик».
В соответствии с Федеральным законом № 61-ФЗ «Об обращении лекарственных средств» в 2014 году все национальные компании, занимающиеся производством ЛС, обязаны были перейти на стандарт GMP, но сегодня только несколько десятков предприятий смогли привести свое производство в соответствие с требованиями государственного стандарта качества.
Постановлением Правительства РФ от 3 декабря 2015 года №1314 утверждены «Правила организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям ».
В мае 2017 года национальные рынки обращения лекарственных средств пяти государств Евразийского экономического союза (ЕАЭС — Россия, Беларусь, Казахстан, Кыргызстан, Армения) объединились и начали работать в формате единого пространства и на основе общих правил надлежащей производственной практики Евразийского экономического союза.
Источник: pharmvestnik.ru