Генетические нарушения у человека и методы их выявления
Генами называются участки ДНК, в которых закодирована структура всех белков в теле человека или любого другого живого организма. В биологии действует правило: «один ген – один белок», то есть в каждом гене содержится информация только об одном определенном белке.
В 1990 году большая группа ученых из разных стран начала проект под названием «Геном человека». Он завершился в 2003 году и помог установить, что человеческий геном содержит 20–25 тысяч генов. Каждый ген представлен двумя копиями, которые кодируют один и тот же белок, но могут немного различаться. Большинство генов одинаковые у всех людей – различается всего 1%.
ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
Гены и геном человека (рассказывает профессор Константин Северинов)

В клетках человека есть структуры, которые называются митохондриями. Они выполняют роль «электростанций» и отвечают за дыхание. Это единственные клеточные органеллы, у которых есть собственная ДНК. И в ней тоже могут возникать нарушения.
Весь набор хромосом в клетке называется кариотипом. В норме у человека он представлен 23 парами хромосом, всего их 46. Выделяют два вида хромосом:
- 22 пары аутосом одинаковы у мужчин и женщин. В каждой паре хромосомы имеют одинаковую длину и содержат одинаковые наборы генов.
- Одна пара половых хромосом. У женщин это две X-хромосомы. Одна из них неактивна и плотно свернута – ее называют тельцем Барра. У мужчин одна половая хромосома представлена X-хромосомой, а вторая – Y-хромосомой, она меньше по размерам.
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
- Грубые изменения в кариотипе – изменение количества хромосом. Например, при синдроме Дауна в клетках ребенка присутствует лишняя хромосома №21.
- Присутствие в организме клеток с разными кариотипами. Это явление называется мозаицизмом.
- Хромосомные аберрации – нарушение структуры хромосом, внутрихромосомные и межхромосомные перестройки. Сюда относятся делеции (утрата участка хромосомы), дупликации (удвоение участка хромосомы), инверсии (поворот участка хромосомы на 180 градусов), транслокации (перенос участка одной хромосомы в другую).

Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:
Старение — это генетическая программа. Как остановить? Просто…
- микроделеции и микродупликации, когда утрачивается или дублируется очень маленький участок хромосомы;
- болезни обмена, вызванные нарушением последовательности «букв» генетического кода в отдельных генах;
- митохондриальные заболевания, связанные с нарушениями в генетическом материале митохондрий;
- низкопроцентный мозаицизм, когда клеток с неправильным кариотипом очень мало;
- мутации в отдельных генах, которые не приводят к изменению внешнего вида хромосом;
- эпигенетические расстройства, при которых структура хромосом и генов не меняется, но изменяется их функция.

Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
Эта методика позволяет в одном исследовании выявлять делеции и дупликации участков ДНК по всему геному. Разрешающая способность стандартного ХМА от 100 000 пар нуклеотидов – «букв» генетического кода (в отдельных регионах от 10 000 п. н.).
С помощью ХМА можно выявлять:
- изменения числа хромосом;
- дупликации и делеции, в том числе микродупликации и микроделеции;
- отсутствие гетерозиготности – утрату одной из двух копий гена. Это явление имеет важное значение в онкологии, при болезнях импринтинга (когда активность гена зависит от того, от какого из родителей он получен), аутосомно-рецессивных заболеваниях (связанных с рецессивными генами – о них мы поговорим ниже), близкородственных браках;
- однородительские дисомии, когда в геноме ребенка присутствуют две хромосомы от одного родителя.
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
- сбалансированные хромосомные аномалии, когда в хромосомах происходят изменения, которые не приводят к добавлению или утрате генетического материала. К ним относятся инверсии (разворот участка хромосомы на 180 градусов), реципрокные транслокации (обмен участками между хромосомами), небольшие инсерции (вставки в хромосомах);
- мозаицизм, если клеток с нарушениями в кариотипе менее 15%;
- CNV (copy number variation) – повторы небольших участков генома;
- точечные мутации – замены отдельных «букв» генетического кода;
- экспансия (увеличение) повторов коротких участков в ДНК;
- аномалии метилирования – присоединения особых метильных групп к определенным участкам ДНК, которые меняют активность генов.
Мутации в генах и заболевания, к которым они способны приводить
Мутации – это изменения, которые происходят в ДНК как случайным образом, так и под действием разных факторов, например химических веществ, ионизирующих излучений. Они могут затрагивать как отдельные «буквы» генетического кода, так и большие участки генома. Мутации происходят постоянно, и это основной двигатель эволюции.
Чаще всего они бывают нейтральными, то есть ни на что не влияют, не приносят ни вреда, ни пользы. В редких случаях встречаются полезные мутации – они дают организму некоторые преимущества. Также встречаются вредные мутации – из-за них нарушается работа важных белков, наоборот, происходят достаточно часто. Генетические изменения, которые происходят более чем у 1% людей, называются полиморфизмами – это нормальная, естественная изменчивость ДНК Полиморфизмы ответственны за множество нормальных отличий между людьми, таких как цвет глаз, волос и группа крови.
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
- Доминантные гены. Выражаясь простым языком, эти гены более «сильные». Если в клетках присутствует хотя бы одна копия такого гена, его признаки проявятся.
- Рецессивные гены «слабее» доминантных. Если у человека одна копия гена доминантная и одна рецессивная, – проявится признак доминантной. А для проявления рецессивного признака нужно две соответствующих копий.

Например, карий цвет глаз у человека является доминантным. Поэтому у кареглазых родителей с высокой вероятностью родится кареглазый ребенок. Если у одного из родителей глаза карие, а у другого голубые, то вероятность рождения кареглазых детей в такой семье тоже высока. У двух голубоглазых родителей, скорее всего, все дети тоже будут голубоглазыми.
А вот у кареглазых родителей может родиться ребенок с голубыми глазами, если у обоих есть рецессивные «гены голубоглазости», и они достанутся ребенку. Конечно, это упрощенная схема, потому что за цвет глаз отвечает не один, а несколько генов, но на практике эти законы наследования зачастую работают. Аналогичным образом потомству могут передаваться и наследственные заболевания.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Секвенирование по Сэнгеру – метод секвенирования (определения последовательности нуклеотидов, буквально – «прочтение» генетического кода) ДНК, также известен как метод обрыва цепи. Анализ используется для подтверждения выявленных мутаций. Это лучший метод для идентификации коротких тандемных повторов и секвенирования отдельных генов. Метод может обрабатывать только относительно короткие последовательности ДНК (до 300–1000 пар оснований) одновременно. Однако самым большим недостатком этого метода является большое количество времени, которое требуется для его проведения.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Панель исследования — тестирование на наличие определенных мутаций, входящих в перечень конкретной панели исследования. Анализ позволяет выявить одномоментно разные мутации, которые могут приводить к генетическим заболеваниям. Анализ позволяет компоновать мутации в панели по частоте встречаемости (скрининговые панели, направленные на выявление носительства патологической мутации, часто встречаемой в данном регионе или в определенной замкнутой популяции) и по поражаемому органу или системе органов (панель «Патология соединительной ткани»). Но и у этого анализа есть ограничения. Анализ не позволяет выявить хромосомные аберрации, мозаицизм и мутации, не включенные в панель, митохондриальные заболевания, а также эпигенетические нарушения.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.

Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров).
Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
- биопсия хориона – когда берут клетки из плаценты;
- амниоцентез – когда берут клетки амниотической жидкости.
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
Источник: reprobank.ru
Генетическая модификация эмбрионов человека: за и против

Биоинженерия — что это такое? Что можно сделать с генами сегодня и каковы перспективы у генетической модификации человека? Насколько этично вмешиваться в геном?
MedAboutMe предлагает поговорить на темы, вызывающие жаркие дискуссии среди ученых.
Ребёнок с подправленными генами: сверхчеловек или биоробот?

Наследственные заболевания — одна из бед человечества. Многие из них неизлечимы, а порой и смертельны. Небольшое нарушение в ДНК — и ребёнок рождается больным или нежизнеспособным.
Хорошо было бы уметь исправлять эти поломки, правда? А заодно подправлять гены так, чтобы малыш обладал большей устойчивостью к другим болезням. А если бы еще научиться программировать его внешность, интеллект, таланты, характер…
Так и до расы сверхлюдей недалеко. Прекрасная перспектива для человечества, не правда ли?
Но вот только у многих эта перспектива вызывает не радость, а неприятный холодок где-то в подсознании. Сверхчеловек, говорите? Совершенный, идеальный… а несовершенным куда деваться? Вымирать тихонько на задворках?
Но пока беспокоиться рано, ведь наука только недавно начала пытаться освоить методы генетической модификации человеческих эмбрионов. Давайте посмотрим, что уже умеют делать ученые, и взвесим плюсы и минусы генной инженерии в приложении к человеку, а не к какой-нибудь там капусте или персикам.

Опасности общественных мест: как оставаться активным и не заражаться?
Лайфхаки личной защиты от вирусов и бактерий в общественных местах и многолюдных местах.
Наследственные болезни и устойчивость организма к инфекциям: первые шаги

В ноябре 2018 года в СМИ появилось сообщение о том, что в Китае родились первые дети с модифицированным геномом. Близняшки Нана и Лулу подверглись на стадии эмбрионов некоторому вмешательству генетиков, в результате чего приобрели врожденный иммунитет к ВИЧ. О рождении генно-модифицированных девочек заявил известный генетик Хэ Цзянкуй из Шэньчжэньского университета.
Правда, официального подтверждения появления ГМО-близняшек пока нет. Их никто не видел, так как, по словам Хэ, родители настаивают на анонимности. Клиника, в которой Хэ якобы проводил работу, также не подтвердила факта рождения детей с модифицированными генами. Не опубликовано и результатов эксперимента, чтобы научное сообщество могло ознакомиться с ним более детально. По некоторым сведениям, ведущие научные издания, в числе которых авторитетные и известные Science и Nature, отказались публиковать результаты работы китайских исследователей по этическим соображениям.
Тем не менее набор супружеских пар для проведения эксперимента действительно проводился в Шэньчженьском университете. Целью являлось получение эмбрионов, устойчивых к заражению ВИЧ. Известно, что люди, у которых в ДНК отсутствует небольшой участок, обозначаемый как CCR5, невосприимчивы к этой опасной инфекции. Ученые намеревались удалить этот участок из ДНК методами генной инженерии на ранних стадиях развития эмбрионов.
В Китае проводились и другие попытки «редактирования» генома: в университете Сунь Ят Сена генетики пытались исправить гены, отвечающие за развитие у человека наследственной болезни под названием «бета-талассемия». Для этого использовалась разработанная несколько лет назад технология CRISPR/Cas9.
Чтобы не вдаваться в дебри молекулярной генетики, суть этого метода можно описать как copy-paste, «вырезать-вставить». Белок Cas9 разрезает в нужном месте ДНК, а специальная РНК (которую ученые научились синтезировать уже довольно давно) определяет и само место, и то, что нужно вставить в разрез. За основу технологии CRISPR/Cas9 была взята система борьбы с вирусами, которой обладали некоторые бактерии. Работает метод просто и считается, что довольно надежно.
Но из 86 эмбрионов удалось получить всего 4 правильно «исправленных». По крайней мере, на заданном участке. А в других местах большой молекулы? Все ли в порядке осталось там?
Именно этот вопрос и не дает покоя тем, кто пытается заглянуть в будущее чуть дальше завтрашнего дня. Ведь все потомки генетически модифицированного ребёнка получат ДНК с изменениями. И неизвестно еще, к каким последствиям это может привести через поколение-другое…
Родители детей с наследственными болезнями очень надеются, что наука сможет однажды помочь тем, в чьих генах имеются поврежденные участки, вызывающие недуг. Но не повредит ли генная модификация другим участкам ДНК?
С растениями и животными проще: из множества полученных результатов можно просто выбрать самые удачные, а остальные уничтожить. С человеческим эмбрионом так обращаться нельзя, ведь для родителей он может быть единственным и неповторимым, драгоценным, уникальным.
Именно поэтому во многих странах генетическое редактирование генома человека запрещено законом.
Этика в генетике
Генетические модификации всегда вызывали споры. Допустимо ли вмешиваться в основу основ, обладая лишь начальными, по сути, познаниями и энтузиазмом? Особенно, когда речь идет о человеке…
Многие страны приняли законы, ограничивающие или запрещающие генную модификацию человеческого генома. В США, например, государство не поддерживает подобных исследований, даже заявки на них не рассматриваются. Но в частных лабораториях ученые могут работать над этими вопросами, с привлечением частных же инвестиций. Недавно был принят закон в Великобритании, разрешающий проведение исследований в данной области, и это до сих пор вызывает споры в британском научном сообществе.
Что же беспокоит ученых, философов и правозащитников?
В первую очередь, отсутствие четкого международного законодательства, регулирующего работы с геномом человека. Многие ученые уверены, что клинические эксперименты с человеческими генами должны быть запрещены, пока не будут хорошо изучены последствия вмешательства. Другие, хотя и соглашаются с необходимостью регулирования, не верят в действенность запретов. «Те, кто захочет заниматься генным модифицированием, обойдут запреты и ограничительные законы и правила. И будет лучше, если исследования будут вестись открыто» — говорят они.
С этической точки зрения вопросов еще больше. Первым встает туманный призрак евгеники — учения сэра Гальтона об улучшении человеческой природы. За ним маячит воспоминание о расовых чистках германских нацистов и их попытках вывести людей особенной породы — истинных арийцев, «белокурых бестий».
Ведь, если станет возможным исключить генетические болезни, сделать потомство более здоровым, то, наверное, можно будет изменить и другие черты? Обеспечить детям высокий интеллект, особенные физические параметры, определенные черты характера, сделать их более «качественными». Сверхлюдьми. По сравнению с которыми все остальные станут… кем? Существами второго сорта, не способными конкурировать с представителями «улучшенной породы»?
А сохранится ли у ГМО-потомства то, что мы называем человечностью? Если личность определяет имеющийся набор генов, то его изменение не повлечет ли за собой и изменение сущности человека?
Кроме того, не будут ли нарушены права того ребёнка, который родится с измененным геномом, ведь его согласия на «редактирование» генов никто не спрашивает?
Всемирно известный ученый Стивен Хокинг, сам страдавший всю жизнь от неизлечимого заболевания, считал, что одной из вероятных причин «Конца света» может стать появление расы сверхлюдей. И многие с ним согласны.
Но другие ученые полагают вполне допустимым редактирование человеческого генома с целью устранения серьезных наследственных заболеваний и соглашаются только с тем, что недопустимы попытки усовершенствования генома для создания потомства с «улучшенными характеристиками». Правда, грань между лечением и улучшением очень зыбкая и допускает множество разночтений.
Вопросов пока гораздо больше, чем ответов. Станет ли человечество здоровее, избавившись от ряда наследственных болезней, или начнет распадаться на расы «улучшенных» людей с определенной специализацией? Покажет время.

Комментарий эксперта
Кэти Ниакан, биолог, первой получила разрешение на работу с геномом человека
Вокруг нашей работы слишком много ажиотажа. Речи пока не идет о внесении в геном каких-либо серьезных изменений. Мы находимся на этапе, когда хотим для начала понять, что нужно для развития эмбриона в нормального ребёнка с хорошим здоровьем, какие гены участвуют в этом процессе, почему происходят выкидыши, и почему некоторые пары остаются бесплодными. Необходимо хорошо изучить самые ранние стадии развития человеческого эмбриона. Это поможет, в частности, увеличить процент успешности процедуры ЭКО.
Мы будем работать с эмбрионами не более чем семидневного возраста, пожертвованными для исследований добровольцами. По истечении 7 дней после оплодотворения зародыши будут уничтожены.

Комментарий эксперта
Марси Дарновски, директор некоммерческой организации Center for Genetics and Society
Генетическая природа человека изучена еще слишком мало, чтобы можно было предвидеть последствия генных модификаций, даже если они совершаются с самыми благими целями. Подправив один участок, можно повредить другой, и неизвестно, к чему это приведет в будущем.
Родителей, мечтающих «дать детям самое лучшее», и имеющих для этого материальные возможности, всегда хватает. Такие родители с легкостью могут согласиться платить за внесение «улучшений» в гены своего потомства, а спрос всегда рождает предложение. И представьте, что станет с обществом, и без того неоднородным, если в нем начнут массово появляться «дизайнерские дети». Мы просто откроем двери к еще одной разновидности дискриминации по признаку «правильной» и «неправильной» генетики.

Комментарий эксперта
Альта Чаро, профессор права и биоэтики
Пока нам неизвестно, могут ли преимущества редактирования генома превысить сопутствующие риски. В любом случае, попытки «улучшить» гены будут доступны немногим, а это несправедливо. Совершенно правильно, что сегодня в США законодательно запрещены попытки дать жизнь эмбрионам с исправленной генетикой.
Источник: medaboutme.ru
Генетика: основные понятия и диагностика
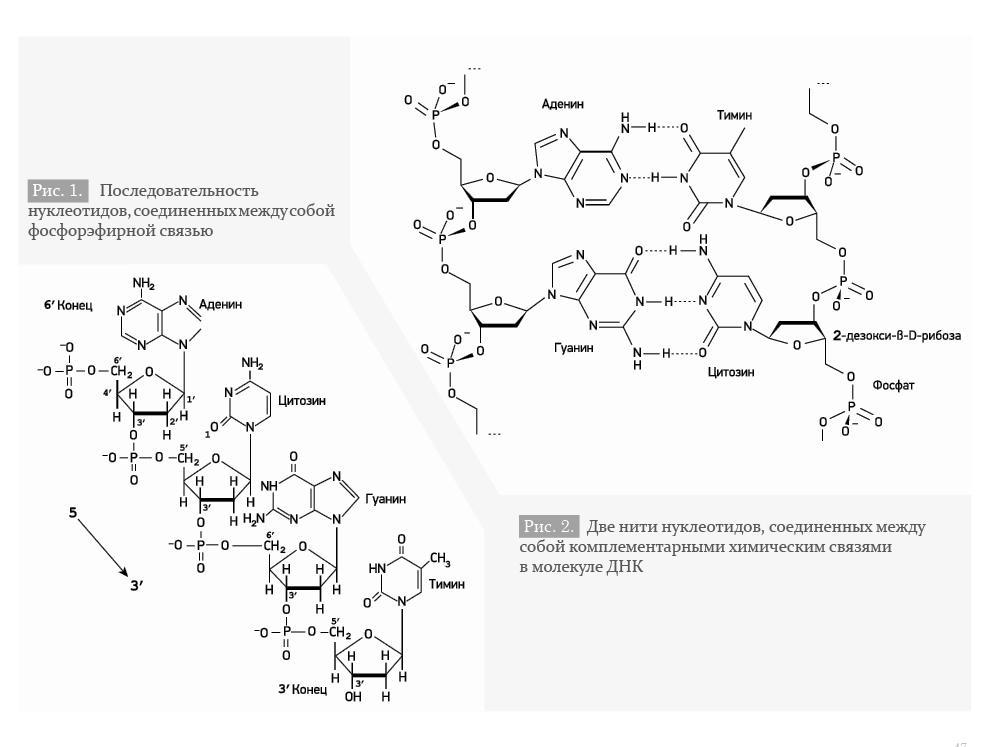
Геном – совокупность наследственного материала, заключенного в клетке организма [1]. Геном содержит биологическую информацию, необходимую для построения организма и поддержания его функций.
Первоначальный смысл этого термина указывал на то, что понятие генома, в отличие от генотипа, является генетической характеристикой вида в целом, а не отдельной особи. С развитием молекулярной генетики значение данного термина изменилось, и сегодня под «геномом» понимают совокупность наследственного материала конкретного представителя вида.
Большинство геномов, в том числе геномы человека и геномы всех остальных клеточных форм жизни, построены из ДНК*. Практически у всех эукариотических организмов все гены организованы в более крупные макромолекулярные комплексы – хромосомы.
У человека наследственный материал соматической клетки представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре, а также клетка обладает множеством копий митохондриальной ДНК. 22 аутосомы, половые хромосомы Х и Y, митохондриальная ДНК человека содержат вместе примерно 3,1 млрд пар оснований [1].
В настоящее время в молекулярной биологии установлено, что гены – это участки ДНК, несущие какую-либо целостную информацию о строении одной молекулы белка или одной молекулы РНК. Эти и другие функциональные молекулы определяют развитие, рост и функционирование организма.
Изначально термин «ген» появился как теоретическая дискретная единица передачи наследственной информации. История биологии помнит споры о том, какие молекулы могут являться носителями наследственной информации. Большинство исследователей считали, что такими носителями могут быть только белки, так как их строение из 20 аминокислот позволяет создать больше вариантов, чем ДНК, состоящая всего из четырех видов
нуклеотидов. Позже было экспериментально доказано, что именно ДНК включает в себя наследственную информацию, что было выражено в виде центральной догмы молекулярной биологии.
Мономеры, составляющие каждую из цепей ДНК, представляют собой сложные органические соединения, включающие в себя азотистые основания: аденин (А), тимин (Т), цитозин (Ц), гуанин (Г), пятиатомный сахар (пентозу) – дезоксирибозу, а также остаток фосфорной кислоты. Эти соединения носят название нуклеотидов (Рис. 1).
Гены могут подвергаться мутациям – случайным или целенаправленным изменениям последовательности нуклеотидов в цепи ДНК. Мутации могут приводить к изменению последовательности, а следовательно, изменению биологических характеристик белка или РНК, что, в свою очередь, может привести к их общему или локальному изменению или аномальному функционированию. Такие мутации являются патогенными, так как их результатом является заболевание, или летальными на эмбриональном уровне. Однако далеко не все изменения последовательности нуклеотидов приводят к изменению структуры белка или к существенному изменению последовательности и не являются патогенными. В частности, геном человека характеризуется такими особенностями, как однонуклеотидные полиморфизмы и вариации числа копий генов (англ. copynumbervariations), которые составляют около 1% всей ДНК человека [2].
Однонуклеотидный полиморфизм (Single nucleotide polymorphism, SNP) – отличие последовательности ДНК размером в один нуклеотид. Если две последовательности ДНК – AAGCCTA и AAGCTTA – отличаются на один нуклеотид, в таком случае говорят о существовании двух аллелей: C и T. SNP возникают в результате точечных мутаций (как правило, типа замен) и, в частности, определяют различные аллели одного гена.
Разнообразием последовательностей ДНК у людей, возможно, объясняется то, как у них происходит течение различных заболеваний, реакции в ответ на патогены, прием лекарств, вакцин и т. п. Знание об однонуклеотидном полиморфизме, вероятно, поможет в понимании фармакокинетики и фармакодинамики действия различных лекарств на человека. Этиология широкого спектра заболеваний, таких как рак, инфекционные, аутоиммунные заболевания, серповидноклеточная анемия и многие другие, включает однонуклеотидные полиморфизмы [3].
Полиморфизмы генов
Именно полиморфизмы генов в большой степени определяют индивидуальные различия в развитии тех или иных физических и психических качеств индивидума. Масштабы полиморфизмов генов у человека таковы, что между последовательностями ДНК двух людей существуют миллионы различий. Эти различия условно подразделяют на четыре основные категории: а) фенотипически не выраженные; б) вызывающие фенотипические различия; в) играющие роль в патогенезе заболевания (при полигенных болезнях); г) играющие основную роль в развитии заболевания (при моногенных болезнях).
На сегодняшний день сформированы обширные базы полиморфизмов, очень гибкие и быстро растущие.
Они постоянно обновляются за счет информации, которую поставляют в клиники и лаборатории по всему миру научные организации, в которых работает множество специалистов в области системной и молекулярной биологии, биоинформатики.
Вариантные формы некоторых генов в определенных условиях могут привести к развитию болезней. Сочетания вариантных генов предрасположенности несут в себе генетические риски множества заболеваний. Тестирование генетических предрасположенностей помогает выявить индивидуальный риск возможности заболевания и установить подверженность влиянию и воздействию негативных факторов окружающей среды.
По клиническим группам полиморфизмов различают патологии систем свертывания крови, обмена фолиевой кислоты, обмена белков костной ткани, гормонов щитовидной железы, стероидных гормонов и еще десятки других групп полиморфизмов.
В настоящее время в лаборатории CL определяются генетические полиморфизмы генов системы свертывания крови: ген F2 (20210_G>A), ген F5 (1691_G>A), ген F7 (10976_G>A), ген F13 (103_G>Т), ген FGB (455_G>A), ген ITGA 2/интегрин α-2/(807_С>Т), ген ITGВ 3/интегрин β-3/ (1565_Т>С), ген PAI-1 (675_5G>4G). Результат исследования содержит интерпретацию и описание рисков, связанных с тем или иным сочетанием. В ближайшее время планируется значительное расширение спектра определяемых полиморфизмов в CL.
Детекция результатов ПЦР проходит в режиме реального времени. Управление прибором осуществляет программное обеспечение. Программа позволяет использовать простое и интуитивное управление с использованием функции «Тест», что значительно сокращает время создания протоколов исследований. Программное обеспечение содержит приложения для количественной оценки ДНК/кДНК, анализа кривых, определения уровня экспрессии генов, исследования биоценозов и SNP-анализа, позволяет использовать функцию «дополнительных стандартов» и формировать протоколы исследования с автоматической трактовкой полученных результатов.
Научно-технический прогресс привел к одному незаменимому открытию в области молекулярной биологии – открытию метода полимеразной цепной реакции (ПЦР), который позволяет обнаружить даже небольшой фрагмент искомого генома. Полимеразная цепная реакция поначалу применялась исключительно в научных лабораториях. Однако вскоре метод нашел свое место в медицине. В 1993 году, Kary Mullis, ученому, открывшему метод ПЦР, была присуждена Нобелевская премия в области химии.
Диагностика полиморфизмов генов в медицинской лаборатории CL
Выявлять полиморфизмы сегодня позволяют методы современной молекулярно-генетической диагностики. В лаборатории CL исследования полиморфизмов проводят с 2012 года методом полимеразной цепной реакции (ПЦР), c помощью детектирующего амплификатора DtPrime производства российской компании «ДНК-Технология». Принцип ПЦР построен на методе многократного комплементарного достраивания матрицы нуклеиновой кислоты до двухцепочечной структуры, которую способен «увидеть» прибор и распознать полиморфизм. Метод ПЦР, помимо быстроты выполнения и манипулятивной простоты, является еще и весьма чувствительным и специфичным. Очень наглядно принцип метода охарактеризован в среде лабораторных работников так: «найти иглу в стоге сена, а затем построить стог из этих игл».
Для того чтобы исключить неточности, один и тот же участок гена исследуется многократно. Вся цепь ДНК разбивается на участки, затем ведется поиск участков, где прогнозируются полиморфизмы. После чего эти участки вырезаются и сопоставляются. С помощью ПЦР количество таких участков увеличивается до 10 в 36–40 степени. Каждый участок вновь прочитывается десятки раз.
Только после этого можно выстроить статистически верную кривую.
Результаты и интерпретация
Информация о наличии полиморфизмов, знание их влияния на определенные виды обмена и уровень чувствительности к лекарственным препаратам позволяют оценить риск развития заболевания, предупредить его развитие и назначить верное лечение.
Важным фактом является то, что генные полиморфизмы в течение жизни не меняются и определяются один раз! Результаты не изменяются в течение жизни и не зависят от физиологического состояния организма.
Генетическое тестирование позволяет в досимптомный период выявить существующие пока только в геноме наследственные тенденции к развитию болезней и наметить пути их ранней профилактики.
Для врачей важна интерпретация результатов анализа полиморфизмов: необходимо понять, как связан тот или иной полиморфизм с вероятностью развития патологического состояния. Следует учитывать, что ни один полиморфизм не является нозологией как таковой, только ее элементом, но зачастую решающим.
Наличие полиморфизмов можно учесть при назначении лекарственных средств. Так, врач-клиницист, руководствуясь рекомендациями генетика, может изменить концентрацию или дозу препарата, который будет влиять на компонент свертывания крови. Безусловно, важны также режим, диета, физиопроцедуры, но основная роль отведена медикаментозному лечению. А это – область фармакогенетики, которая изучает реакции организма на определенные препараты согласно особенностям генома человека.
Интеграция наук
15 лет назад было заявлено, что расшифрован геном человека. Это открытие стало возможным благодаря многолетней работе ученых различных отраслей науки, уровень которой достиг тех высот, в которых информация и знания из одной области проникают в другую. Такая «интеграция наук» выводит на качественно новый уровень дальнейшее развитие биотехнологий, медицины, генетики, геномики. Каких горизонтов достигнут ученые при детальном знании генома человека, прогнозировать трудно. Можно быть готовым лишь к тому, что природа поставит перед человеком новые, не менее сложные задачи и амбициозные цели.
Материал опубликован в специализированном издании для врачей ProTest, выпуск 2, август 2015 г. При использовании материалов ссылка на журнал обязательна.
Источник: oxy-center.ru
Генетика и онкология: главные вопросы
Что такое онкоген? Как возникают мутации в ДНК? Какие мутации провоцируют рак? Кому и чем могут помочь молекулярно-генетические исследования?
На эти и другие вопросы во Всемирный день ДНК отвечает Александр Олегович Иванцов – доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.

Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название – геном.
У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов.
Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название – мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации – в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель.
Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее.
Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Кому и чем могут помочь генетические исследования? Верно ли, что от генетического исследования может зависеть успех лечения? Кому стоит пройти генетическое исследование на мутации?
— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %).
Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно.
Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого.
Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины.
В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
Источник: nii-onco.ru