Что такое руководство по GAMP 5?
ГАМП 5: Риск-ориентированный подход к компьютеризированным системам, соответствующим GxP предоставляет прагматичные и практические отраслевые рекомендации, направленные на создание совместимых компьютеризированных систем, которые подходят для использования по назначению эффективным и действенным образом, а также позволяют внедрять инновации и технологические достижения.
Из них Когда был представлен GAMP? GAMP был инициирован в 1991 Дэвид Селби (председатель-учредитель) и Клайв Тайлер с ядром экспертов в Соединенном Королевстве, которые поняли, что фармацевтическая промышленность должна учитывать и удовлетворять меняющиеся ожидания FDA и других регулирующих органов в отношении соответствия и проверки компьютеризированных систем в результате ряда …
Какова основная цель GAMP? Целью сообщества является способствовать пониманию регулирования и использования автоматизированных систем в фармацевтической промышленности. GAMP COP организует дискуссионные форумы для своих членов.
SUPER JUMP за 5 минут!
Впоследствии, что такое CSV в фармацевтике? Проверка компьютерной системы в фармацевтической промышленности
Он определяет руководящие принципы проверки компьютерных систем и контролирует соблюдение компаниями норм. Для компаний из ЕС проверка программного обеспечения CSV, используемого медицинскими устройствами, также является обязательной.
Что такое GAMP Категория 3?
GAMP Категория 3 – Ненастраиваемое программное обеспечение
Электронный самописец который также настроен с входными диапазонами, уставками сигналов тревоги и т. д., подпадает под категорию 3 GAMP, поскольку, хотя он имеет параметры, введенные в конфигурации, он не определяет функциональность или поток процесса.
Почему он называется GAMP 5? GAMP 5 Обоснование.
Аббревиатура GAMP-5 относится к «Надлежащая автоматическая производственная практика, выпуск 5», документ. Хотя GAMP 5 не имеет юридического статуса и носит исключительно рекомендательный характер, он содержит информацию и методологии, представляющие интерес для всех, кто занимается валидацией в регулируемой среде cGMP.
Какие преимущества предоставляет GAMP регулируемым компаниям и поставщикам? Для пользователей руководство GAMP дает принципы, которые гарантируют, что автоматизированная система подходит для предполагаемого использования до того, как фармацевтические продукты будут произведены, в то время как поставщики руководствуются GAMP для проверки и тестирования любых предотвратимых дефектов в системе. следовательно, обеспечение продуктов, поставляемых фармацевтической…
Что такое компьютерная валидация в науках о жизни? Проверка компьютерной системы (CSV) практика обеспечения того, чтобы любое программное или аппаратное обеспечение, соответствующее своему назначению, соответствовало нормативным требованиям.. … CSV происходит во время жизненного цикла разработки программного обеспечения и выполняет множество действий, таких как статическое тестирование и динамическое тестирование.
JetBrains: почему нужно пользоваться своим продуктом // Подкаст «Для tech и этих»
Зачем нам нужна проверка компьютерной системы?
Проверка компьютерной системы помогает гарантировать, что как новые, так и существующие компьютерные системы последовательно выполняют свое предназначение и дают точные и надежные результаты которые обеспечивают соответствие нормативным требованиям, выполнение требований пользователей и возможность распознавать недействительные и/или измененные записи.
Что такое GxP? GxP это сборник руководящих принципов и правил качества создан для обеспечения безопасности био/фармацевтических продуктов, их использования по назначению и соответствия процессам качества при производстве, контроле, хранении и распределении.
Что такое система проверки?
Под верификацией системы обычно понимается к применению тестовых случаев, полученных из системных требований, к интегрированной системе. … Верификация системы — это не только демонстрация набора требуемых свойств системы.
Что такое команда CSV? План специалистов CSV, написать, реализовать и просмотрите протоколы проверки компьютерных систем, действующие в строго регулируемых производственных отраслях. Их работа необходима для обеспечения того, чтобы все компьютерные системы работали должным образом (с документами, подтверждающими это) и соответствовали нормативным требованиям.
В чем разница между категорией GAMP 4 и 5?
В GAMP 4 было 5 категорий программного обеспечения, но в GAMP 5 оно было изменено с 5 категорий на 4 категории и упоминалось ниже: Категория 1: Программное обеспечение для инфраструктуры, включая операционную систему, менеджеры баз данных. … Категория 4: настроенное программное обеспечение, т. е. LIMS, SCADA, CDS, DCS. Категория 5: Заказное программное обеспечение.
Является ли GAMP регламентом?
Даже если GAMP 5 не является регламентом но руководства, состоящие из наборов принципов и процедур, направленных на обеспечение того, чтобы производимые фармацевтические продукты соответствовали требуемому стандарту качества, приняли большинство фармацевтических компаний, намеревающихся создать автоматизированные системы, пригодные для использования по назначению…
Что такое гамп4? GAMP 4 означает Хорошие автоматизированные производственные процессы со ссылкой на Международное общество инженеров-фармацевтов.
В чем разница между GAMP 4 и GAMP 5? Категория-5:
Специальное (специальное) программное обеспечение [GAMP-4]: эти системы разрабатываются для удовлетворения конкретных потребностей компании-пользователя. Пользовательские приложения [GAMP-5]: Эти системы или подсистемы разработаны для удовлетворения конкретных потребностей регулируемой компании. Внутренний риск высок.
Применяется ли GAMP к медицинским устройствам?
«Зрелое» руководство по валидации компьютеризированных систем в производство медицинских изделий.
Что такое GxP и GAMP? А Подход на основе GAMP к системам мониторинга окружающей среды для приложений GxP. … Качество должно быть встроено в систему, начиная с проектирования. С автоматизированным проектированием систем, основанным на качестве продукции в качестве основной цели, подход GAMP помогает гарантировать, что системы подходят для использования в средах, регулируемых GxP.
Каков первый шаг проверки отчета?
В зависимости от риска и сложности программного обеспечения должны выполняться различные уровни строгости проверки.
- Шаг 1: Создайте план проверки. …
- Шаг 2: Определите системные требования. …
- Шаг 3: Создайте протокол проверки и спецификации тестирования. …
- Шаг 4: Тестирование. …
- Шаг 5: Разработайте/пересмотрите процедуры и окончательный отчет.
Что означает валидация системы? Валидация системы (продукта, услуги или предприятия) чтобы продемонстрировать, что продукт, услуга или предприятие удовлетворяют системным требованиям и/или требованиям заинтересованных сторон. Деятельность. Подтвердить действие или задачу — значит убедиться, что ее результаты соответствуют входным данным. Обработать.
Что такое компьютерная система?
Компьютерная система – это набор интегрированных устройств, которые вводят, выводят, обрабатывают и хранят данные и информацию. В настоящее время компьютерные системы строятся вокруг как минимум одного устройства цифровой обработки. В компьютерной системе есть пять основных аппаратных компонентов: устройства ввода, обработки, хранения, вывода и связи.
Что такое CSV в GMP? Проверка компьютерных систем (CSV) — это процесс, используемый для тестирования, проверки и официального документирования того, что регулируемая компьютерная система делает именно то, для чего она предназначена, последовательно и точно, безопасно, надежно и отслеживаемо.
Что такое CSV FDA?
CSV (Проверка компьютерной системы) также называется проверкой программного обеспечения. Проекты проверки выполняются регулируемыми компаниями, чтобы продемонстрировать, что их программное обеспечение или система работают должным образом, а не так, как они были разработаны. FDA определяет валидацию как.
Что такое CSV Life Science? Сектор / НАУКИ О ЖИЗНИ / CSV: проверка компьютеризированных систем в отрасли наук о жизни. Растущее использование цифровых технологий в фармацевтической промышленности, в частности, делает CSV (Проверка компьютерной системы), который контролирует автоматизированное производство необходимых лекарств.
Не забудьте поделиться этим постом
Источник: celebrity.fm
ВАЛИДАЦИЯ КОМПЬЮТЕРИЗИРОВАННЫХ СИСТЕМ
Зачем проводят валидацию Компьютеризированных Систем (КС)?
В современном производстве лекарственных препаратов GMP выдвигает определенные требования к качеству лекарственных средств, и ко всем этапам производства, от которых оно может зависеть.
Именно потому, что необходимой составляющей любого производства являются компьютеризированные системы, управляющие производственными процессами, и содержащие важную информацию, обусловленна необходимость проверки корректности их работы и соответствия нормам GMP- то есть проведения валидации.
Для решения этой проблемы разработан ряд методологий, в которых раскрываются подходы относительно достижения описанного в GMP результата (GAMP 5).
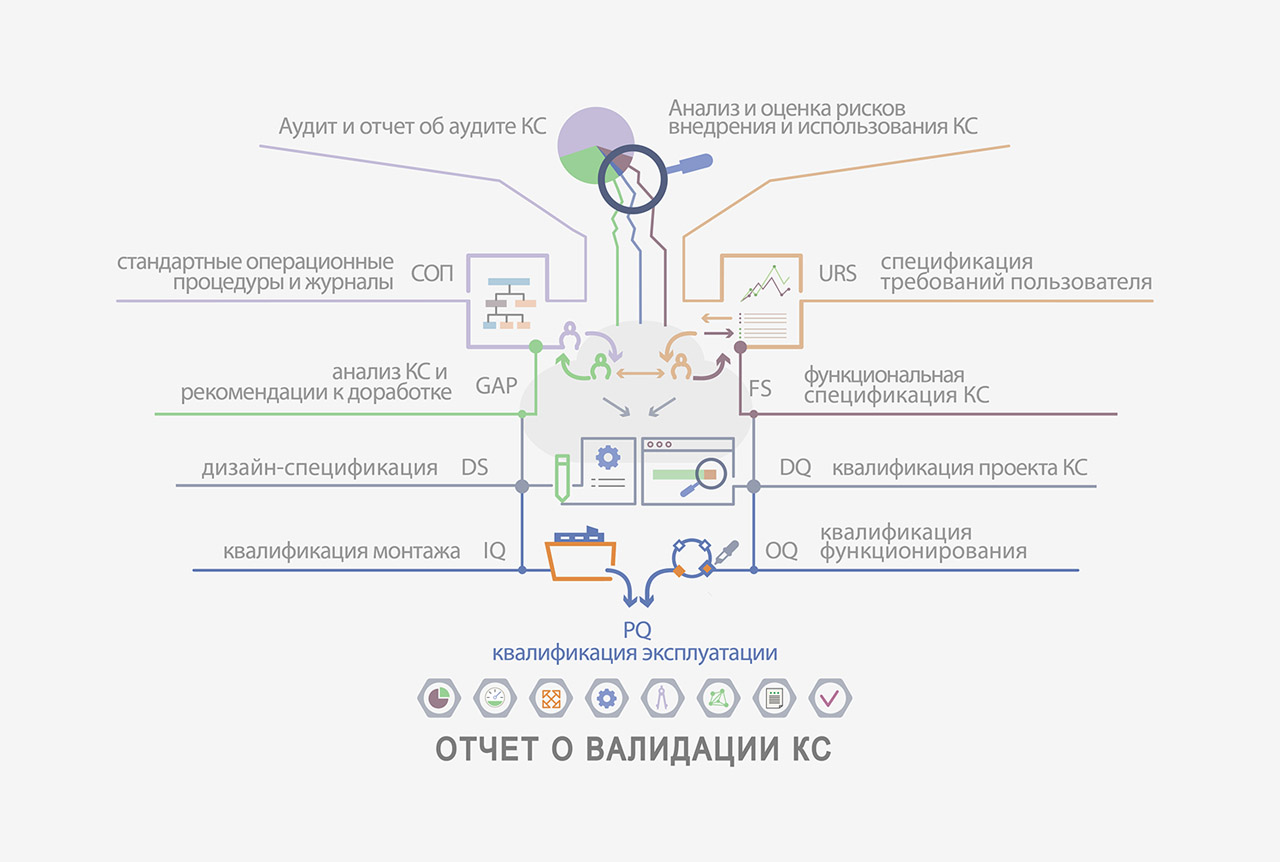
ПРОЦЕССЫ ВАЛИДАЦИИ:
- Проверка описания и разработки системы (DQ);
- Проверка способности инфраструктуры системы поддерживать работу системы (IQ);
- Проверка способности функционировать согласно требованиям (OQ);
- Проверка способности компании использовать систему (PQ).
Объем мероприятий, проводимый, при валидации КС определяется с учетом критичности процесса для качества продукта (оценка рисков), сложности системы и стандартности/нестандартности используемого оборудования, технологий, программного обеспечения.
GAMP подразделяет компьютеризированные системы на 5 категорий:
- Системное программное обеспечение (ПО);
- Микропрограмма (ПО в аппаратных устройствах);
- ПО, готовое для использования;
- Конфигурируемое ПО;
- Самостоятельно разработанное специальное ПО.
В зависимости от того, к какой категории относится ваш программный продукт, необходимо выбрать этапы валидации.
ОБЩАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ РАБОТ:
- Разработка Валидационного мастер плана ( Validation Master Plan — документ в котором указан перечень систем, подлежащих валидации, сроки и должностные лица, ответственные за каждый этап процесса) данной системы. Определение объема и способа приложения первичных документов (откликов системы). Определение порядка работы при появлении отклонений.
- Сбор требований пользователя к возможностям системы. Опрос всех пользователей с целью уточнения необходимого функционала, уровней доступа, количества пользователей в группах и количества точек доступа.
- Сбор требований к информационно-технологической инфраструктуре.
- Проведение анализа рисков проекта внедрения КС с целью определения объема валидационных работ и построение матрицы прослеживаемости с целью определения выполнения всех требований Правил.
- Разработка, согласование и утверждение протоколов до начала испытаний.
- Проведение испытаний. Формирование отчетов.
После завершения процесса валидации компания получает документальное свидетельство того, что компьютеризированная система работает правильно, а это существенно снижает риск возникновения ошибок, затраты рабочего времени на их выявление и исправление, и внесение соответствующих изменений.
УПРАВЛЕНИЕ КАЧЕСТВОМ
В своей деятельности мы используем систему управления качеством предоставляемых услуг (Система Менеджмента Качества) и процессное управление в соответствии со стандартами ITIL (IT Infrastructure Library — библиотека инфраструктуры информационных технологий, описывающая лучшие из применяемых на практике способов организации работы подразделений или компаний, занимающихся предоставлением услуг в области информационных технологий, соответствует стандартам серии ISO 9000).
ВЫСОКИЕ СТАНДАРТЫ В РАБОТЕ
- Правила организации производства и контроля качества лекарственных средств, утвержденные приказом Минпромторга России № 916 от 14.06.2013
- GAMP 5. A Risk-Based Approach to Compliant GxP Computerized Systems. ISPE. 2008
- Validation of computerised systems. PA/PH/OMCL (08) 69 3R. EDQM
- GAMP Good Practice Guide: A Risk-Based Approach to Operation of GxP Computerized Systems. ISPE 2009
ООО «КОМТЕХБЮРО» сертифицировано
на соответствие стандарту
ГОСТ ISO 9001:2011



РЕАЛИЗОВАННЫЕ ПРОЕКТЫ ПО ВАЛИДАЦИИ КС

ДОКУМЕНТЫ ВАЛИДАЦИИ
- Карта процессов (блок-схема)
- Анализ рисков процессов
- Спецификации требований пользователей (URS)
- Техническое задание
- Выбор платформы, SWOT анализ
- Функциональная спецификация (FS)
- Проектная спецификация (DS)
- Отчет о сравнении
- Протокол анализа рисков функций
- Квалификация КС (DQ)
- Протоколы и отчеты по стадиям IQ, OQ, PQ
- Отчет о несоответствиях, План CAPA
- Матрица прослеживаемости
- Итоговый отчет
ДОКУМЕНТЫ УПРАВЛЕНИЯ КАЧЕСТВОМ
- СОП «Управление учетными записями пользователей КС»
- СОП «Резервное копирование и аварийное восстановление КС»
- СОП «Периодическая оценка КС»
- СОП «Управление изменениями в КС»
- СОП «Управление инцидентами в КС»
- СОП «Управление конфигурациями»
- СОП «Обслуживание АРМ пользователя КС»
- СОП «Управление жизненным циклом КС»
Источник: www.comtb.ru
Как организовать валидацию компьютеризированных систем

Стоит задача организовать валидацию компьютеризированных систем с нуля. Однако, при организованных процессах квалификации и валидации, это вовсе не означает, что в этом направлении нулевые наработки.
Например, если имеем “свечной заводик”, где есть несколько участков/подразделений/цехов, каждая субъединица имеет свой набор оборудования и систем и, соответственно, компьютеризированных систем, которые управляют ими (разной категоризации согласно GAMP 5), то это означает, что “по касательной” компьютеризированные системы были затронуты в ходе первичных квалификаций оборудования и систем. Например, система приготовления растворов конструктивно имеет контроллер (PLC) c прошитой конкретной программой и панель управления / управляющий компьютер (HMI), опять же с конкретной прошитой программой (исполняемым файлом).
При квалификации подобной системы мы неизбежно на этапе IQ должны коснуться её Hardware, на этапе OQ проверить правильность функционирования органов управления, реакцию системы на аварийные ситуации, доступ по паролям, создание рецептур, сохранение и распечатку параметров процесса и т.п. Т.е. собственно вопрос квалификации ПО в значительной степени выполнен – далее все управляется контролем изменений и отклонений в валидированной системе.
Верификация программного кода во многом ответственность поставщика системы. Например, достаточно от него получить письменное подтверждение, что ПО протестировано в соответствии с требованиями GAMP 5 и тем самым исчерпать вопрос.
Самостоятельно ведь мало кто сможет ковырять Step7/WinCC (в случае платформы Сименс), да и поставщики обычно не оставляют такой возможности конечному пользователю. Максимум что могло быть сделано, это совместная верификация на этапе приемки таковых систем. Это случай уже работающего оборудования и пример, когда компьютеризированная система является частью automated manufacturing equipment, как буквально указано в Приложении М1 GAMP 5 Validation Planning (пункт 2 Scope). Там же значится для такого случая, что separate computer system validation should be avoided, т.е. отдельная валидация комп. системы не требуется. Что буквально подтверждает мою интуитивную догадку выше для подобных случаев.
Второй момент, скажем, LIMS или система электронного документооборота, или система ERP (или вообще любая другая система, включая вновь проектируемую или непроквалифицированную до этого производственную систему / оборудование). Здесь никто и ничего не начинал. Это означает, что должны быть пройдены все “7 кругов ада”, т. е. мы должны:
1. Определить систему (URS, FS, TS – если этого нет / не сохранилось, то фактически воссоздать заново в достаточном для проведения валидации объеме).
2. Определить и спланировать стратегию валидации (Валидационный план, анализ рисков)
3. Подготовить шаги валидации (DQ, IQ, OQ, PQ) и т.п.
Т.е. нам буквально необходимо вскочить на подножку уже идущего поезда под названием GMP, как это часто бывает, а не создать что-то принципиально новое в пустыне Сахара с нуля.
Предположим, что собственно квалификацию и валидацию уже охватывают разрабатываемые на периодической основе ВМП, распределенные по подразделениям. В фокусе квалификации – имеющиеся в соотв. подразделении оборудование и системы, в фокусе валидации – имеющаяся номенклатура препаратов.
По ним описаны объемы квалификации / реквалификации / валидации, сроки, критерии приемлемости, процедура управления изменениями, распределены роли и ответственности и т.п. По компьютеризированным системам (далее – КС), как уже было показано выше, в 90 % случаев ПО отдельных единиц охвачено в рамках квалификации этих единиц.
Из общего числа КС выделяются (в плане критичности) системы визуализации, скажем систем получения, хранения и распределения воды очищенной, системы управления и мониторинга систем кондиционирования воздуха для чистых помещений и т.п. Формально они также были рассмотрены в рамках квалификации, но их не мешало бы ещё раз прогнать последовательно по пунктам 4-17 Приложения 11 действующего Руководства по надлежащей производственной практике (GMP) – скажем, их квалификация была выполнена до 2011 года (когда вступило в силу указанное Приложение 11) – вполне вероятно что квалификация не затрагивала вопросы миграции данных или непрерывности бизнес-процесса. Для автомата групповой упаковки вроде бы как это не обязательно и можно элементарно “отбить” анализом рисков. От водоподготовки так уже не отмахнешься.
GAMP 5 нам предлагает создать ВМП, где далее, по необходимости на каждую из КС создать индивидуальный ВП. В таком случае это получается по 2-3 таких критичных КС на подразделение/участок. Допустимо ли при этом создать один общефирменный ВМП, который не будет иметь принадлежности к подразделениям, где будут перечисленные все КС, из них выделены критические (скажем, по категориям GAMP5), далее для наиболее критических КС создать отдельные ВП (допустимо согласно Приложения М1 иметь общие планы или планы-генерики для аналогичных систем), например, системы визуализации систем кондиционирования чистых помещений в целом аналогичны, не суть важно какие именно подразделения они представляют (классы чистоты или время деконтаминации, скажем, “интересны” при квалификации, при валидации таковой КС важна способность системы хранить данные, распечатывать тренды, реагировать на выход параметров за установленные пределы и т.п.).
В п. 5.3 Приложения М1 GAMP5 описано, что должен включать в себя валидационный план (во многом перепевка того, что в первом же ответе написал AntonM) – при необходимости могу привести этот перечень буквально.
Но начинать всё же стоит, на мой взгляд, с общего, а уже потом двигаться к частному. Чтобы валидация КС не растворилась в общей валидационной деятельности видится целесообразным регламентировать её отдельным ВМП, а в этом отдельном ВМП (при предложенной вариативности и гибкости “под конкретную ситуацию”) предлагается изложить буквально следующее (п. 4.1 Приложения М1 GAMP5):
– summary of facilities, systems, equipment, or process in scope;
– current status of these facilities, systems, equipment, or processes
– change control process to be followed
– planning and scheduling (incuding activities for new systems, activities driven by change, and periodic review)
что буквально означает:
– сводная информация по производственным участкам, системам, оборудованию и процессам, которые входят в фокус
– текущий статус этих производственных участков, систем, оборудования или процессов
– процесс управления изменениями, которому надлежит следовать
– планирование и расписание (включая деятельность для новых систем, деятельность происходящую от изменений и периодический пересмотр).
Вроде как от этого можно оттолкнуться.
Начать я решил “в лоб” с того, что изложено в Приложении М1 GAMP 5, называется оно Validation Planning (как уже было указано). Помимо воды (Introduction https://pharm-community.com/2013/5100/» target=»_blank»]pharm-community.com[/mask_link]
Автоматизация производства по стандартам GMP/GAMP 5

ПРАВИЛА НАДЛЕЖАЩЕЙ ПРОИЗВОДСТВЕННОЙ ПРАКТИКИ (GMP) ЕВРАЗИЙСКОГО ЭКОНОМИЧЕСКОГО СОЮЗА, Приложение 11
Подготовка к валидационным испытаниям
- разработать необходимые документы и методики,
- провести совместно с Заказчиком аттестацию, квалификационные испытания оборудования и систем,
- окажут консультационную поддержку при проведении валидационных испытаний.
Уровень подготовки наших сотрудников позволяет работать не только в рамках перспективной валидации, но и проводить обследования и готовить к ретроспективной валидации существующие компьютеризированные системы, например в сфере производства лекарственных средств.
Системы автоматизации фармацевтического производства, SCADA
Сегодня уже все знают, что одним из направлений снижения затрат и повышения качества выпускаемой продукции является исключение из технологического процесса человеческого фактора и максимальное использование средств автоматизации. Однако, регулируемые производства, в том числе выпускающие лекарственные средства предъявляют к технологическим процессам, контролю качества и оборудованию всё более жесткие требования. При внедрении компьютеризированных систем это значит, что как минимум, архитектура создаваемой системы должна предполагать прохождение валидационных испытаний и соответствовать требованиям GMP/GAMP 5, а процесс разработки и внедрения должен проходить по V- модели.
Команда специалистов компании НОРВИКС-ТЕХНОЛОДЖИ, обладает большим опытом создания систем автоматизации различного назначения и области применения. Мы готовы предложить заказчикам разработку и создание SCADA, автоматизированных компьютерных систем для мониторинга параметров технологического оборудования, диспетчерского управления и анализа накопленных данных. С самого начала работы над проектами для фармацевтических производств мы придерживаемся условий последующего прохождения системами валидационных испытаний и обеспечиваем создание необходимой документации.
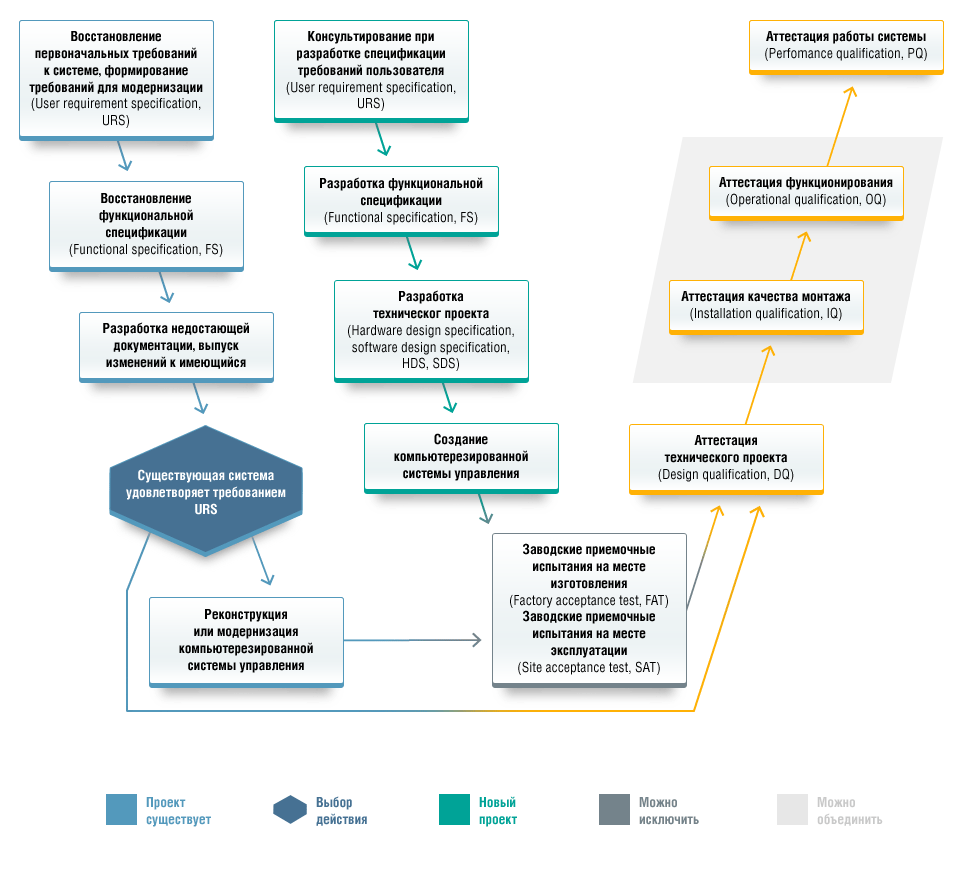
Модернизация
Расширение производства, переход на новые технологические процессы, моральное устаревание оборудования, изменение требований к уровню контроля — наиболее частые причины, требующие проведения модернизации или реконструкции автоматизированных систем.
Мы готовы помочь своим клиентам:
- Определить целесообразность проведения модернизации.
- Совместно выбрать оптимальный с точки зрения стоимости владения, качества и соответствия требованиям стандартов вариант проведения изменений.
- Выполнить поставку, монтаж и настройку новых элементов системы.
- Внести необходимые изменения в проектную и, там где это нужно, валидационную документацию.
Подробнее об одном из примеров модернизации системы автоматизированного управления для соответствия требованиям ГОСТ/GMP вы можете прочитать в статье сотрудника нашей компании «Модернизация и валидационные испытания программно-аппаратного комплекса этиленоксидной стерилизации», СТА 2/2016.
Мы готовы начать с любого уровня:
Источник: www.norvix.ru